题目内容
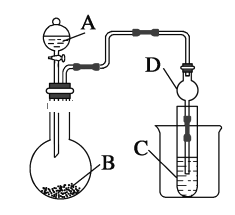
【题目】利用下图装置可以验证非金属性的变化规律。
(1)仪器A的名称为________,球形管D的作用是________。
(2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫:装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为有淡黄色沉淀生成,离子方程式为____________________________________________________________。
(3)若要证明非金属性:C>Si,则A中加________、B中加Na2CO3、C中加________,观察到C中溶液的现象为_____________________________
【答案】分液漏斗 防止倒吸 浓盐酸 KMnO4 Na2S溶液 S2-+Cl2===S↓+2Cl- 硫酸 Na2SiO3溶液 有白色胶状沉淀产生
【解析】
(1)仪器A的名称为分液漏斗,球形管D的作用是防止倒吸;
(2)通过证明Cl2氧化性大于S,验证氯的非金属性大于硫;
(3)通过证明碳酸酸性大于硅酸,来证明非金属性:C>Si。
(1)仪器A的名称为分液漏斗,球形管D的作用是防止倒吸;
(2)先利用浓盐酸和KMnO4来制取Cl2,再用Cl2与Na2S反应产生S验证氯的非金属性大于硫。故装置A、B、C中所装药品分别为浓盐酸、KMnO4、Na2S,装置C中的离子方程式为S2-+Cl2===S↓+2Cl-;
(3)要证明非金属性:C>Si,则A中加稀硫酸、B中加Na2CO3,产生二氧化碳气体,C中加Na2SiO3溶液,观察到C中溶液的现象为有白色胶状沉淀产生。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目