题目内容
【题目】如图是可逆反应A+2B![]() 2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况。由此可推断下列结论错误的是( )
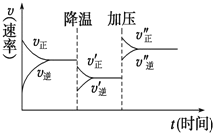
A.正反应是放热反应B.A、B一定都是气体
C.D一定不是气体D.C可能是气体
【答案】D
【解析】
根据图象可知,降低温度后,v正′>v逆′,平衡右移,故正反应为放热反应,故A正确;增大压强后,v正″、v逆″均立即增大且v正″>v逆″,平衡右移,故此反应为有气体参加和生成的反应,且正反应为气体的物质的量减小的反应。故若A和B均为气体,则D一定不是气体,C一定是气体;若A或B任何一种不是气体,若使平衡右移,则需C和D均不是气体,则无法满足加压时v逆″也立即增大的情况,故不成立。即A和B均为气体,C一定为气体,D一定不是气体,故B、C正确,D错误。故选:D。

 新思维寒假作业系列答案
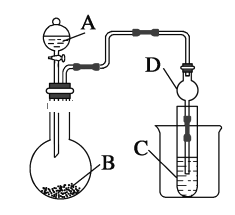
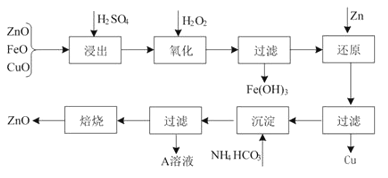
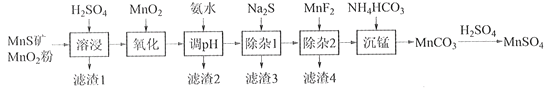
新思维寒假作业系列答案【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。