题目内容
【题目】(1)1.7g氨气在标准状况下的体积是_____________升,共含有_____________mol电子;0.1mol硫化氢共含有_____________个质子,同质量的氨气和硫化氢气体中分子个数比为_____________,含氢原子的个数比为_____________。在标准状况下硫化氢的密度为_____________。
(2)在标准状况下,18gCO和CO2的混合气体完全燃烧后得到11.2LCO2,则原混合气体的密度是_____________,原混合气体中,CO的质量是_____________,CO2的体积是_____________碳原子和氧原子的个数比为_____________。
【答案】2.24 1 1.08×1024(或1.8NA) 2:1 3:1 1.52gL-1 1.6g/L 7 5.6L 2:3
【解析】
(1)氨气的摩尔质量为17g/mol,由n=![]() =
=![]() =0.1mol,则标况下V=nVm=0.1mol×22.4L/mol=2.24L,含有的电子为0.1mol×10=1mol;
=0.1mol,则标况下V=nVm=0.1mol×22.4L/mol=2.24L,含有的电子为0.1mol×10=1mol;
0.1mol硫化氢含有质子数为0.1mol×(1×2+16)×NA=1.8×6.02×1023(或1.8NA),
硫化氢的摩尔质量为34g/mol,同质量的氨气和硫化氢的物质的量之比为:=2:1,
则同质量的氨气和硫化氢气体中分子个数比为2:1,
含氢原子个数比为2×3:1×2=3:1,
由ρ=![]() 可知标准状况下硫化氢的密度为ρ=
可知标准状况下硫化氢的密度为ρ=![]() =1.52gL-1,
=1.52gL-1,
故答案为:2.24;1;1.08×6.02×1024(或1.8NA);2:1;3:1;1.52gL-1;
(2)混合气体的密度=![]() =1.6g/L,令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积,则:
=1.6g/L,令CO和CO2的物质的量分别为xmol、ymol,根据二者质量及体积,则: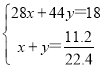
解得x=0.25,y=0.25,
原混合气体中,CO的质量是0.25mol×28g/mol=7g,
标况下,CO2的体积是0.25mol×22.4L/mol=5.6L,
碳原子和氧原子的个数比为(0.25mol+0.25mol):(0.25mol+0.25mol×2)=2:3,
故答案为:1.6g/L;7;5.6L;2:3。

 阅读快车系列答案
阅读快车系列答案