题目内容
【题目】NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.等物质的量的NaCl和MgCl2所含Cl-物质的量相等
B.1.7gH2O2中含有电子数为0.9NA
C.常温下,1L0.1mol·L-1的NH4NO3溶液中含氮原子数为0.2NA
D.常温常压下,32gSO2物质的量为0.5mol
【答案】A
【解析】
A. 1mol的NaCl中含有Cl-物质的量为1mol,1mol的MgCl2所含Cl-物质的量为2mol,Cl-物质的量不相等,故A错误
B. 1.7gH2O2中含有电子数为:![]() =0.9NA,故B正确;
=0.9NA,故B正确;
C. 常温下,1L0.1mol/L的NH4NO3溶液含有硝酸铵物质的量为:0.1mol/L×1L=0.1mol,含氮原子数为:0.1mol×2×NA =0.2NA,故C正确;
D. 常温常压下,32gSO2物质的量为=![]() =0.5mol,故D正确;
=0.5mol,故D正确;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】已知反应2CH3OH(g)![]() CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g),在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应进行到某时刻测得各组分的浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
下列叙述中正确的是( )
A. 增大CH3OH的浓度,可使活化分子百分数增多,反应速率加快
B. 该时刻正、逆反应速率的大小:v正<v逆
C. 平衡时c(CH3OH)=0.04 mol·L-1
D. 若加入CH3OH,经10 min反应达到平衡,该时间内反应速率v(CH3OH)=1.6 mol·L-1·min-1
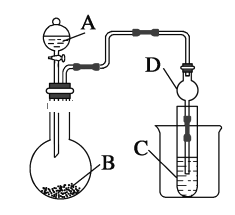
【题目】实验室需要配制NaOH溶液和硫酸溶液。
Ⅰ、配制100mL 1.0mol·L-1 NaOH溶液

(1)如图所示的仪器中E的名称为___,配制溶液肯定不需要的仪器是___(填序号),还需增加的玻璃仪器有___(填仪器名称)。
(2)在配制NaOH溶液时
①根据计算用托盘天平称取NaOH的质量为___g。
②下列操作对所配溶液浓度的影响是(填“偏高”“偏低”“无影响”)。
操作 | 浓度影响 |
用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了 | ___ |
没有洗涤烧杯和玻璃棒 | ___ |
定容时,仰视读数 | ___ |
容器E未干燥,残余少量水 | ___ |
Ⅱ、配制100mL 0.5mol·L-1 硫酸溶液
用质量分数为98%,密度为1.84g·cm-3的浓硫酸来配制该溶液,该浓硫酸物质的量浓度为___mol·L-1,所需浓硫酸的体积为___mL (计算结果保留一位小数)。
【题目】下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)( )
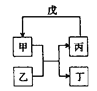
选项 | 甲 | 乙 | 丙 | 戊 |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH | NaAlO2 | CO2 |
D | Br2 | FeI2 | FeBr3 | Cl2 |
A. AB. BC. CD. D