题目内容
12. 乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如:
乙烯的产量可以用来衡量一个国家的石油化工发展水平,这是因为乙烯能够转化为许多重要的有机化工原料,例如:C2H4$→_{300℃7-8MPa}^{H_{2}O,H_{3}PO_{4}/硅藻土}$CH3CH2OH$→_{Cu或Ag,△}^{O_{2}}$CH3CHO$→_{催化剂}^{O_{2}}$CH3COOH
请回答下列问题:
(1)写出下列化学方程式:乙烯与氯化氢反应CH2═CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl,乙醇催化氧化为乙醛2C2H5OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O.
(2)乙烯与丙烯既可以分别发生反应生成聚合物,也可以按一定比例相互反应生成聚合物,写出其中任意两种聚合物的结构简式:
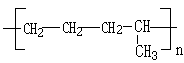 、
、 .
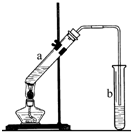
.(3)如图,在a试管中先加入2mL 95%的乙醇,并在摇动下缓缓加入3mL浓硫酸,再加入2mL乙酸,充分摇匀.按图连接好装置,用酒精灯对a试管小火加热3~5min后,改用大火加热,当观察到b试管中有明显现象时停止实验.请回答下列问题:
①写出制取乙酸乙酯的化学方程式:CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.②在b试管中盛装的溶液是饱和碳酸钠溶液,其作用是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯.
分析 (1)乙烯可以和氯化氢之间发生加成反应生成氯乙烷,乙醇催化氧化生成乙醛;
(2)不饱和化合物发生加聚反应时,双键中的有一个键断裂,不饱和的碳原子相互连接成为长链,双键两侧碳原子上的原子团,不能在高聚物的主碳链上;
(3)①酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;
②用饱和碳酸钠溶液吸收乙酸乙酯,乙醇溶解,碳酸钠与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度.
解答 解:(1)乙烯含有碳碳不饱和键,可以和氯化氢之间发生加成反应生成氯乙烷,化学方程式为CH2═CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl,乙醇被催化氧化,醇羟基上的氢和与羟基相连的碳上的氢脱去,成乙醛,反应的化学方程式为2C2H5OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O,
故答案为:CH2═CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl;2C2H5OH+O2$→_{△}^{Cu/Ag}$2CH3CHO+2H2O;
(2)乙烯和丙烯中都双键,按物质的量之比为1:1聚合时,可生成聚合物乙丙树脂,该聚合物的结构简式可能是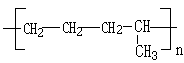
 ,
,
故答案为: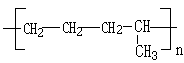
 ;
;
(3)①酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,
CH3COOC2H5+H2O,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
②乙醇与乙酸都易挥发,制备的乙酸乙酯含有乙醇与乙酸,通常用饱和碳酸钠溶液吸收乙酸乙酯,中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味,溶解挥发出来的乙醇,降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:饱和碳酸钠溶液;中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯.
点评 本题考查有机物的结构和性质,侧重考查有机化学反应方程式书写,为高频考点,把握有机物的结构与性质、官能团与性质的关系为解答的关键,注意有机反应条件,(2)按一定比例相互反应生成聚合物为易错点,题目难度中等.

 同步轻松练习系列答案
同步轻松练习系列答案| A. | 食盐 | B. | 食醋 | C. | 蔗糖 | D. | 水 |
| A. | H2 | B. | CO | C. | CH4 | D. | 煤气(CO和H2) |
| A. | 显酸性 | B. | 显碱性 | ||
| C. | 显中性 | D. | 不能确定其酸碱性 |
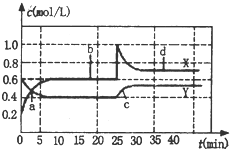 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )| A. | 图中共有两条曲线X和Y,其中曲线X表示 NO2浓度随时间的变化 | |
| B. | a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d | |
| C. | 若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积 | |
| D. | 反应进行至25min时,曲线发生变化的原因是加入0.4 mol N2O4 |