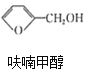
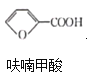
题目内容
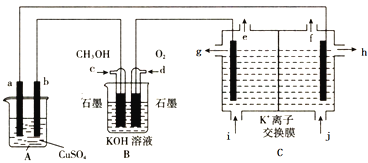
【题目】氮及其化合物的转化过程如图所示,下列分析合理的是
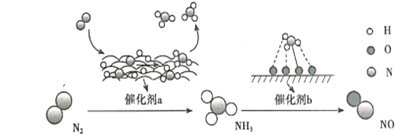
A. 催化剂a表面发生了极性共价键的断裂和形成
B. 在催化剂b表面形成氮氧键时,不涉及电子转移
C. N2与H2反应生成NH3的原子利用率为100%
D. 催化剂a、b能提高反应的平衡转化率
【答案】C
【解析】
A.催化剂a表面是氢气和氮气反应生成氨气,催化剂a表面发生了非极性共价键的断裂和极性键的形成,故A错误;
B.催化剂b表面是氨气催化氧化生成NO的反应,有电子转移,发生的是氧化还原反应,故B错误;
C.N2与H2反应生成NH3,反应物参加反应过程中原子利用率为100%,故C正确;
D.催化剂a、b改变反应速率,不改变化学平衡,不能提高反应的平衡转化率,故D错误;
故选C。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(2)浸出液中加入NaClO3的目的是____________________________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是_____(填化学式)。
(4)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______;其使用的适宜pH范围是___。

A.2.02.5 B.3.03.5 C.4.04.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =____________。