题目内容
【题目】如图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。

(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13)中含____个σ键,____个键。
(2)a与b的元素形成的10电子中性分子X的空间构型为_____;将X溶于水后的溶液滴入到AgNO3溶液中至过量,得到配离子的化学式为_____,其中X与Ag+之间以_____键结合。
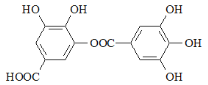
(3)氢键的形成对物质的性质具有一定的影响.![]() 的沸点_____。(填高或低)
的沸点_____。(填高或低)
(4)如图是上述六种元素中的一种元素形成的最高价含氧酸的结构:请简要说明该物质易溶于水的两个原因:_____________。
【答案】3 2 三角锥形 [Ag(NH3)2]+ 配位 高 HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的﹣OH易与水分子之间形成氢键
【解析】
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13),则a为H,f为C,该分子为CH≡CH;
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,能以配位键形成银氨络离子;
(3)氢键主要影响物质的熔沸点;
(4)由图可知为硝酸的结构,含有-OH易形成氢键。
(1)单质a、f对应的元素以原子个数比1:1形成的分子(相同条件下对H2的相对密度为13),则a为H,f为C,该分子为CH≡CH,则含2个C-Hσ键和1个C-Cσ键和2个π键,故答案为:3;2。
(2)a与b的元素形成的10电子中性分子X,结合熔点可知,b为N,X为NH3,空间结构为三角锥形,能以配位键形成银氨络离子,其化学式为[Ag(NH3)2]+,故答案为:三角锥形;[Ag(NH3)2]+;配位。
(3)氢键主要影响物质的熔沸点,使含氢键的物质的沸点高,故答案为:高;
(4)由图可知为硝酸的结构,含有-OH易与水分子之间形成氢键,且HNO3是极性分子,易溶于极性的水中,则易溶于水,故答案为:HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的﹣OH易与水分子之间形成氢键。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(2)浸出液中加入NaClO3的目的是____________________________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是_____(填化学式)。
(4)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______;其使用的适宜pH范围是___。

A.2.02.5 B.3.03.5 C.4.04.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =____________。