题目内容
20.关于实验室制取乙炔,下列描述合理的是( )| A. | 乙炔气体中常含有杂质,通常采用硫酸铜溶液洗气除杂 | |
| B. | 为了加快此反应的反应速率,通常往水中加入少许盐酸 | |
| C. | 将生成的气体直接通往溴水中,溴水褪色则证明产生了乙炔 | |
| D. | 通常采取向上排空气法收集乙炔 |
分析 A.硫酸铜溶液能吸收其中的杂质硫化氢;
B.电石与水反应非常剧烈,实验室制取乙炔本质为碳化钙和水电离出的氢离子结合生成乙炔气;
C.生成的乙炔中含有硫化氢等还原性气体;
D.根据乙炔、空气的密度分析解答.
解答 解:A.硫酸铜溶液能吸收其中的杂质硫化氢,所以用硫酸铜溶液洗气是为了除去杂质,故A正确;
B.电石与水反应非常剧烈,通常用饱和食盐水代替水,减缓反应的速率,往水中加入少许盐酸,反应会更加剧烈使反应无法控制反应速率,易酿成事故,故B错误;
C.电石中含有硫化物,与水反应生成硫化氢气体,硫化氢气体具有还原性,能与溴水发生氧化还原反应:Br2+H2S═S↓+2HBr,硫化氢也能使溴水溶液中的溴单质还原而褪色,故C错误;
D.乙炔的式量为24,空气的平均式量为29,应用向下排空气法收集,乙炔难溶于水,也可以用排水法收集,故D错误;
故选A.
点评 本题以乙炔的实验室制法为载体考查了乙炔的性质,题目难度不大,明确制备乙炔的原理和乙炔的性质是解题的关键.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
8.反应2A(g)?2B(g)+C(g) H>0,在未用催化剂的条件下已达平衡,现要使正反应速率降低,c(B)减小,应采取的措施是( )
| A. | 升温 | B. | 减小反应器的体积 | ||
| C. | 增大 | D. | 降温 |
15.如图球棍模型对应物质中不具有哪种官能团( )


| A. | 羧基 | B. | 氨基 | C. | 羟基 | D. | 醛基 |
5.常温下,有①Na2CO3溶液、②NaHCO3溶液、③氨水、④NH4Cl溶液各25mL,其物质的量浓度均为0.1mol•L-1.关于上述四种溶液的说法正确的是( )
| A. | 水的电离程度:①<② | |
| B. | ①、②中粒子浓度关系均符合:c(Na+)c(H+)═c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 将③、④混合,所得溶液的pH>7,则该溶液中:c(NH4+)═c(NH3×H2O) | |
| D. | 向③、④中分别加入25mL0.1mol•L-1盐酸后,溶液中c(NH4+):③<④ |
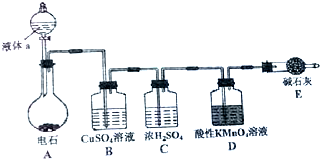 如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.
如图是某课外小组制取乙炔并测定乙炔的某些性质的实验.