题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.1.0 mol·L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
| B.1.0 mol·L-1的HNO3溶液:K+、[Ag(NH3)2]+、Cl-、SO42- |
| C.1.0 mol·L-1的KI溶液: Na+、Fe3+、Cl-、SO42- |
| D.澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- |
D
解析试题分析:A、CO32-与Ca2+生成沉淀不能大量共存,错误;B、酸性条件下[Ag(NH3)2]+不能大量共存,错误;C、Fe3+与I-发生氧化还原反应而不能大量共存,错误D、正确。
考点:考查溶液中离子共存有关问题。

练习册系列答案
相关题目
下列各组离子或分子在指定溶液中一定能大量共存的是
| A.能使pH试纸呈红色的溶液:Fe2+、Mg2+、NO3-、Cl— |
| B.在饱和的氯水中:SO42-、NH4+、A13+、CH3CHO |
| C.加入A1能放出H2的溶液中:Cl—、SO32-、NO3-、HCO3- |
D.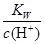 =0.1mol/L的溶液:Na+、K+、SiO32-、A1O2- =0.1mol/L的溶液:Na+、K+、SiO32-、A1O2- |
下列反应的离子方程式错误的是
| A.等物质的量的Ba (OH)2与NH4HSO4在溶液中反应: Ba2++2OH-+NH4++H++SO42-  BaSO4+NH3?H2O+H2O BaSO4+NH3?H2O+H2O |
B.氢氧化铁与足量的氢溴酸溶液反应:Fe(OH)3+3H+ Fe3++3H2O Fe3++3H2O |
C.足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O 2HCO3- 2HCO3- |
D.酸性条件下KIO3溶液和KI溶液反应生成I2:IO3-+5I-+3H2O  3I2+6OH- 3I2+6OH- |
下列解释事实的化学方程式或离子方程式不正确的是
| A.钢铁发生吸氧腐蚀:2Fe + O2 + 2H2O = 2Fe(OH)2 |
| B.SO2使紫色石蕊溶液变红色:SO2 + H2O = 2H+ + SO32- |
| C.利用NaOH溶液除去金属铝表面的氧化膜:Al2O3 + 2OH- = 2AlO2- + H2O |
| D.84消毒液和洁厕灵混合使用会产生有毒气体:Cl- + ClO- + 2H+ = Cl2↑+H2O |
下列判断正确的是
| A.甲基橙呈红色的溶液中一定存在NH4+、Ba2+、AlO2-、Cl- |
| B.同一主族元素气态氢化物中,相对分子质量越大,沸点越高 |
| C.实验室制乙烯时,加入浓硫酸其作用既降低了反应的活化能,又起到脱水作用 |
| D.将过量Na2O2投入紫色石蕊溶液,溶液显蓝色,Na2O2是碱性氧化物 |
下列各组离子在指定条件下,一定能大量共存的是
A.能使蓝色石蕊试纸变红色的溶液: 、 、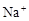 、 、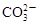 、 、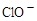 |
B.c(H+)=0.1mol·L-1的透明溶液: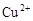 、 、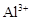 、 、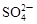 、 、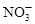 |
C.能使氢氧化铝溶解的溶液: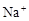 、 、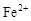 、 、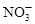 、 、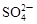 |
D.水电离出的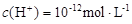 的溶液: 的溶液: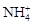 、 、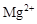 、 、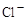 、 、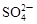 |
下表中有关离子方程式的评价合理的是 ( )
| 选项 | 化学反应及离子方程式 | 评价 |
| A | AlCl3溶液中加入过量氨水: Al3++3NH3·H2O=Al(OH)3¯+3NH4+ | 错误,铝元素的产物应该是AlO2﹣(或[Al(OH)4﹣]) |
| B | 过量氯气通入溴化亚铁溶液中: 3Cl2+2Fe2++4Br-=6Cl-+2Fe3++2Br2 | 正确 |
| C | 用氨水吸收过量二氧化硫: 2NH3·H2O+SO2=2NH4++SO32-十H2O | 正确 |
| D | 氯化铵溶于水: NH4+ + 2H2O = H3O+ + NH3·H2O | 错误,氯化铵溶解于水是物理变化,不能写离子方程式 |
常温下,下列各组离子在特定溶液中一定能大量共存的是
| A.pH=12的澄清的溶液中:K+、Na+、MnO4-、SO42- |
| B.c(Al3+) ="0.1" mol·L-1的溶液中:Na+、Cl-、HCO3-、SO42- |
| C.甲基橙呈红色的溶液中:NH4+、Ba2+、AlO2-、Cl- |
| D.加入少量铝粉后能产生氢气的溶液中:NH4+、Fe2+、NO3-、SO42- |
在下列溶液中,能大量共存的一组离子是
| A.pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- |
| B.通入过量SO2气体的溶液中:Fe3+、NO3-、Ba2+、H+ |
| C.c(Al3+)=0.1 mol/L的溶液中:Na+、K+、AlO2-、SO42- |
| D.由水电离出的c(H+)=1×10-13mol/L的溶液中:Na+、HCO3-、Cl-、Br- |