题目内容
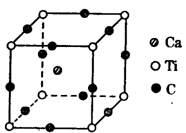
(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp="x" ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp="x" ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
(14分)(每空2分)(1)N≡N 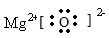
(2)2Mg+CO2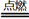 2MgO+C
2MgO+C
(3)3SO2+3Ba2++2 H2O +2NO3-=3BaSO4↓+2NO↑+4 H+ SO2
(4)NH4H SO4 100x
(2)2Mg+CO2
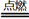 2MgO+C
2MgO+C(3)3SO2+3Ba2++2 H2O +2NO3-=3BaSO4↓+2NO↑+4 H+ SO2
(4)NH4H SO4 100x
试题分析:A元素的一种核素中不含中子,则A是H元素;使品红溶液褪色的化合物应是SO2,所以F是S元素,D是O元素;B比D的原子序数小,且B的单质在D2中燃烧可生成BD和BD2两种气体,则B是C元素;则C是N元素,E是Mg元素。
(1)氮气分子中存在氮氮三键,所以其结构式为N≡N ;MgO是离子化合物,所以其电子式为
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,黑色固体为单质C,白色固体为MgO,所以化学方程式为2Mg+CO2
 2MgO+C
2MgO+C(3)SO2气体通入BaCl2和HNO3的混合溶液中,被硝酸氧化成硫酸根离子,与钡离子结合生成硫酸钡沉淀,离子方程式为3SO2+3Ba2++2 H2O +2NO3-=3BaSO4↓+2NO↑+4 H+;在该反应中硝酸作氧化剂,NO是还原产物,SO2作还原剂,所以SO2的还原性大于NO的还原性;
(4)H、N、O、S四种元素构成的化合物一般为铵盐,所以按原子个数比为5 :1 :4 :1形成化合物甲的化学式为NH4H SO4;Ba2+的物质的量是SO42-的物质的量的3倍,所以二者结合成BaSO4后,溶液中有Ba2+剩余,其物质的量浓度是(0.03mol/L-0.01mol/L)/2=0.01mol/L,根据该沉淀的Ksp=c(Ba2+)c(SO42-)="x" ,所以则混合溶液中酸根离子的浓度c(SO42-)="x/" c(Ba2+)=100x。

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目

 ”或“
”或“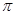 ”)。
”)。