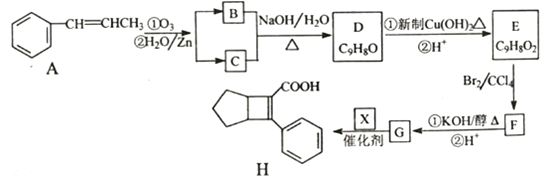
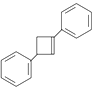
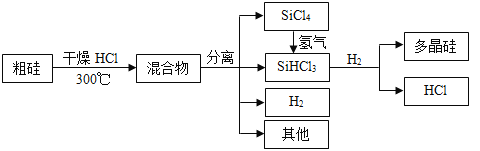
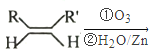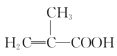��Ŀ����
����Ŀ��C��N��S�������ﳣ�����һЩ�������⣬���й����������о��ø��ֻ�ѧ������������Щ���ʶԻ����IJ���Ӱ�졣
(1)��֪��2CO(g)��O2(g)=2CO2(g) ��H1=��566kJ/molS(l)��O2(g)=SO2(g) ��H2=��296kJ/mol
һ�������£�����ͨ��CO��SO2��Ӧ����S(1)��һ���������壬ʵ��ȼú��������Ļ��գ�д���÷�Ӧ���Ȼ�ѧ����ʽ_______________________________��
(2)��500���ºϳɼ״��ķ�Ӧԭ��Ϊ��
CO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0 kpa�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ=��ѹ�����ʵ�������)
CH3OH(g)��H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2��ѹǿΪp0 kpa�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��(���淴Ӧ��ƽ�ⳣ��������ƽ��Ũ�ȼ��㣬Ҳ������ƽ���ѹKp����ƽ��Ũ�ȣ������ѹ=��ѹ�����ʵ�������)

��0~4min��H2��ƽ����Ӧ����v(H2)=________mol��L1��min1��
��CO2ƽ��ʱ���������Ϊ______________�����¶���KpΪ_________kPa-2_(�ú���p0��ʽ�ӱ�ʾ��С�������1λ)��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����______________��
A��v��(CH3OH)=3v��(H2)
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1
C�����º�ѹ�£������������ٱ仯
D�����º����£�������ܶȲ��ٱ仯
��500�桢��2���ݻ�����2L���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
���� | ������ | ������ |
��Ӧ����ʼͶ���� | 1mol CO2��3mol H2 | 0.5mol CO2��1mol H2 1mol CH3OH��1mol H2O |
CH3OH��ƽ��Ũ��/mol��L1 | C1 | C2 |
���������з�Ӧ��ʼ��________(��������Ӧ�������淴Ӧ��)������У�c1_________(����>����<������=��)c2��
���𰸡�2CO(g)��SO2(g)=S(l)��2CO2(g) ��H=��270kJ/mol 0.375 10% 256/3p02 C �淴Ӧ <
��������
��1������ԭ���غ㣬CO��SO2��Ӧ����S��1����һ������������CO2����ѧ����ʽΪ2CO��g��+SO2��g��=S��l��+2CO2��g����������������Ȼ�ѧ����ʽ��ϸ�˹���ɽ������㡣
��2���ٽ��![]() ���㣻
���㣻
�ڷ�Ӧ���е�15minʱ�������Ũ�Ȳ��䣬��ʱ�ﵽƽ��״̬����������ʽ�������������
�۴ﵽƽ��ʱ�����淴Ӧ������ȣ��Ҹ����ʵ�Ũ�Ȳ��䣬�Դ��ж��Ƿ�ƽ��״̬��
�ܿɸ�������ͼ�����Ӧ��ƽ�ⳣ������������Ͷ�Ϲ鵽�ұ��൱����1mol�״���1molˮ������
����1������ԭ���غ㣬���ɵ��������Ƕ�����̼�������ķ�ӦΪ2CO��g��+SO2��g��=S��l��+2CO2��g��������������Ȼ�ѧ����ʽ�����������α��Ϊ�ٺ͢ڣ����ݸ�˹���ɢ�-�ڿɵ�����Ӧ���Ȼ�ѧ����ʽ����2CO��g��+SO2��g��=S��l��+2CO2��g����H=-566kJ/mol-��-296kJ/mol��=-270kJ/mol��
�ʴ�Ϊ��2CO��g��+SO2��g��=S��l��+2CO2��g����H=-270kJ/mol��
��2����0��4 min��CO��Ũ�ȼ�����0.5mol/L����������Ũ�ȼ�����1.5mol/L��H2��ƽ����Ӧ����v��H2��=1.5mol/L��4min=0.375molL-1min-1��
�ʴ�Ϊ��0.375��
�ڷ�Ӧ

CO2ƽ��ʱ�������������Ũ�Ȱٷֱȣ���![]() ����ʼʱ����1 mol CO2��3 mol H2��ѹǿΪp0 ��ƽ��ʱ�����������ʵ���Ϊ2.5mol��ѹǿΪ0.625p0 ��
����ʼʱ����1 mol CO2��3 mol H2��ѹǿΪp0 ��ƽ��ʱ�����������ʵ���Ϊ2.5mol��ѹǿΪ0.625p0 ��
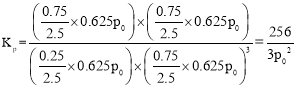 ��
��
�ʴ�Ϊ��10%��256/3p02��
��A��v����CH3OH��=3v����H2��˵�����淴Ӧ���ʲ���ȣ��ʲ���˵����Ӧ�Ѵ�ƽ�⣬��A����
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1����Ͷ���йأ�����˵����Ӧ�Ѵ�ƽ�⣬��B����
C�����º�ѹ�£������������ٱ仯��˵����Ӧ�Ѵ�ƽ�⣬��C��ȷ��
D�����º����£�������ܶȲ���һ�����������䲻�ٱ仯������˵����Ӧ�ﵽƽ�⣬��D����
�ʴ�Ϊ��C��
��������Qc=![]() =8���ɸ�������ͼ�����Ӧ��ƽ�ⳣ��
=8���ɸ�������ͼ�����Ӧ��ƽ�ⳣ��![]() =5.3��Qc��K��ƽ��������С���������Ͷ�Ϲ鵽�ұ��൱����1mol�״���1molˮ��������������ƽ��ʱc1��c2��
=5.3��Qc��K��ƽ��������С���������Ͷ�Ϲ鵽�ұ��൱����1mol�״���1molˮ��������������ƽ��ʱc1��c2��
�ʴ�Ϊ���淴Ӧ������