题目内容
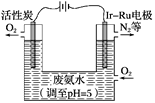
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:

①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
【答案】 催化剂的作用 温度过高,硝酸浓度过大,导致H2C2O4进一步被氧化 碘水 布氏漏斗、吸滤器 无色突变为淡紫色且半分钟不褪色 84%
【解析】(1)淀粉水解需要浓硫酸作催化剂,即浓硫酸的作用是提高淀粉水解的速度(或起到催化剂的作用)。
(2)由于温度过高、硝酸浓度过大,会导致产物H2C2O4进一步被氧化,所以不能滴入的过快。
(3)由于碘能和淀粉发生显色反应,所以可以用碘水来检验淀粉是否完全水解。
(4)减压过滤时需要布氏漏斗、吸滤瓶。
(5)由于酸性高锰酸钾溶液是显紫红色的,所以当反应达到终点时,溶液颜色由无色突变为淡紫色且半分钟不褪色。根据滴定管的读数可知,消耗高锰酸钾溶液是18.50ml-2.50ml=16.00ml。根据方程式可知,草酸的物质的量是0.020 mol·L-1×0.016L×5/2=0.0008mol,则草酸晶体样品中二水合草酸的质量分数为![]()