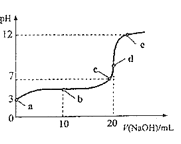
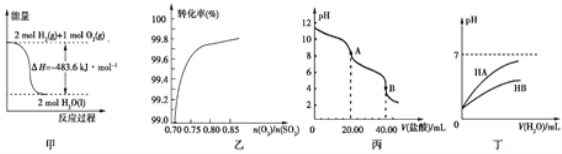
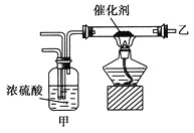
题目内容
【题目】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
NaCN+HNO2![]() HCN+NaNO2 NaCN+HF
HCN+NaNO2 NaCN+HF![]() HCN+NaF NaNO2+HF
HCN+NaF NaNO2+HF![]() HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是
A.K(HF)=7.2×10-4B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出结论D.K(HCN)<K(HNO2)<K(HF)
【答案】B
【解析】
相同温度下,酸的电离常数越大,该酸的酸性越强,强酸能和弱酸的盐反应生成弱酸,根据NaCN+HNO2=HCN+NaNO2、NaCN+HF=HCN+NaF、NaNO2+HF=HNO2+NaF知,酸的强弱顺序是HCN<HNO2<HF,则酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),据此分析解答。
A.通过以上分析知,K(HF)最大为7.2×10-4,故A正确;
B.根据以上分析知,K(HNO2)处于中间,为4.6×10-4,故B错误;
C.根据NaCN+HNO2=HCN+NaNO2、NaCN+HF=HCN+NaF即可得出强弱顺序是HCN<HNO2<HF,故C正确;
D.通过以上分析知,酸的电离平衡常数大小顺序为K(HCN)<K(HNO2)<K(HF),故D正确;
答案选B。

【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/molS(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)

①0~4min,H2的平均反应速率v(H2)=________mol·L1·min1。
②CO2平衡时的体积分数为______________,该温度下Kp为_________kPa-2_(用含有p0的式子表示,小数点后保留1位)。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L1 | C1 | C2 |
则乙容器中反应起始向________(填“正反应”或“逆反应”)方向进行;c1_________(填“>”“<”或“=”)c2。