题目内容
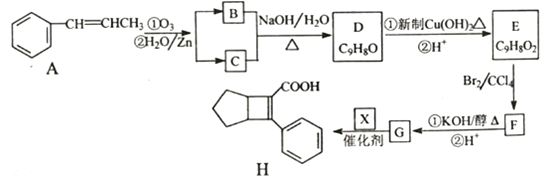
【题目】化合物H是一种邮寄材料中间体。实验室由芳香烃A制备H的一种合成路线如下:
已知:①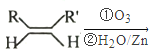 RCHO+RCHO
RCHO+RCHO
②RCHO+RCH2CHO![]() +H2O
+H2O
③![]()
请回答下列问题:
(1)芳香化合物B的名称为_________,C的同系物中相对分子质量最小的结构简式为__________。
(2)由E生成F的反应类型为_________。
(3)X的结构简式为_________。
(4)写出D生成E的第①步反应的化学方程式_______________。
(5)G与乙醇发生酯化反应生成化合物Y,Y有多种同分异构体,其中符合下列条件的同分异构体有____种,写出其中任意一种的结构简式________。
①分子中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2;
②其核磁共振氢谱显示有4种不同化学键环境的氢,且峰面积之比为6:2:1:1。
(6)写出用![]() 为原料制备化合物
为原料制备化合物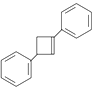 的合成路线,其他无机试剂任选。________
的合成路线,其他无机试剂任选。________
【答案】苯甲醛 HCHO 加成反应 ![]()
![]() +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH ![]()
![]() +Cu2O↓+3H2O 4
+Cu2O↓+3H2O 4 
【解析】
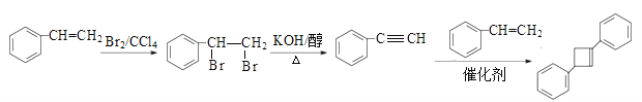
根据A→B+C的反应试剂,结合题给已知①②,芳香族化合物B的结构简式为 ![]() ,C的结构简式为CH3CHO;B、C中都含醛基,B+C→D发生题给已知②的反应,结合D的分子式C9H8O,D的结构简式为
,C的结构简式为CH3CHO;B、C中都含醛基,B+C→D发生题给已知②的反应,结合D的分子式C9H8O,D的结构简式为 ![]() ;D与新制Cu(OH)2、加热,D中醛基发生氧化反应,产物酸化后得到的E的结构简式为
;D与新制Cu(OH)2、加热,D中醛基发生氧化反应,产物酸化后得到的E的结构简式为 ![]() ;E与Br2/CCl4发生加成反应生成F,F的结构简式为
;E与Br2/CCl4发生加成反应生成F,F的结构简式为 ![]() ;F在KOH/醇、加热发生消去反应,酸化后得到的G的结构简式为
;F在KOH/醇、加热发生消去反应,酸化后得到的G的结构简式为 ![]() ;根据题给已知③,G+X→H,结合H的结构简式逆推出X的结构简式为
;根据题给已知③,G+X→H,结合H的结构简式逆推出X的结构简式为 ![]() 。
。
(1)B的结构简式为 ![]() ,B的名称为苯甲醛。C的结构简式为HCHO, HCHO属于饱和一元醛,C的同系物中相对分子质量最小的结构简式为HCHO。故答案为:苯甲醛 ,HCHO;
,B的名称为苯甲醛。C的结构简式为HCHO, HCHO属于饱和一元醛,C的同系物中相对分子质量最小的结构简式为HCHO。故答案为:苯甲醛 ,HCHO;
(2)E与Br2/CCl4发生加成反应生成F ,F的结构简式为 ![]() ,故答案为:加成反应;
,故答案为:加成反应;
(3)根据上述分析,X的结构简式为 ![]() 。故答案为:
。故答案为:![]() ;
;
(4)D生成E的第①步反应的化学方程式为 ![]() +2 Cu(OH)2+NaOH
+2 Cu(OH)2+NaOH ![]()
![]() +Cu2O↓+3H2O。故答案为:
+Cu2O↓+3H2O。故答案为:![]() +2 Cu(OH)2+NaOH
+2 Cu(OH)2+NaOH ![]()
![]() +Cu2O↓+3H2O;
+Cu2O↓+3H2O;
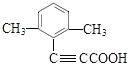
(5)G的结构简式为 ![]() ,G与乙醇发生酯化反应生成的Y的结构简式为
,G与乙醇发生酯化反应生成的Y的结构简式为 ![]() 。Y的不饱和度为7,含有的官能团为碳碳三键和酯基,Y的同分异构体中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2,说明Y的同分异构体中含—COOH;Y的同分异构体的核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1;符合条件的同分异构体有
。Y的不饱和度为7,含有的官能团为碳碳三键和酯基,Y的同分异构体中含有苯环,且能与饱和碳酸氢钠溶液反应放出CO2,说明Y的同分异构体中含—COOH;Y的同分异构体的核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1;符合条件的同分异构体有 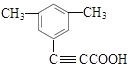 、
、  、
、  、
、 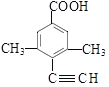 ,符合条件的同分异构体共4种。故答案为:4,
,符合条件的同分异构体共4种。故答案为:4, ;
;
(6)对比 ![]() 和
和 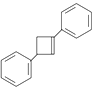 的结构简式,结合题给已知③,由
的结构简式,结合题给已知③,由 ![]() 与
与 ![]() 在催化剂存在时反应可生成
在催化剂存在时反应可生成  。需要由
。需要由 ![]() 合成
合成 ![]() ,
, ![]() 与
与 ![]() 碳干骨架不变,侧链官能团由碳碳双键变为碳碳三键,结合有机物之间的相互转化,由
碳干骨架不变,侧链官能团由碳碳双键变为碳碳三键,结合有机物之间的相互转化,由 ![]() 先与Br2/CCl4发生加成反应生成
先与Br2/CCl4发生加成反应生成 ![]() ,
, ![]() 在强碱醇溶液中发生消去反应生成
在强碱醇溶液中发生消去反应生成 ![]() ,合成路线的流程图为:
,合成路线的流程图为: 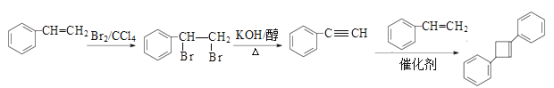 ,故答案为:
,故答案为: 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]() _____________
_____________![]() 。
。
(2)在容积均为![]() 的两个恒容密闭容器中发生反应
的两个恒容密闭容器中发生反应![]() ,有关数据如下:
,有关数据如下:
容器 | 温度 | 起始量 | 达到平衡 | |||
|
|
| CO转化率 | 所需时间 | ||
1 | 800 | 2 | 1 |
| 3 | |
2 | 800 | 1 | 2 | n | x | |
①![]() 时该反应的平衡常数
时该反应的平衡常数![]() ___________。
___________。
②容器2中,![]() ___________,
___________,![]() ___________。
___________。
③若![]() 起始时,在
起始时,在![]() 恒容密闭容器中加入CO、
恒容密闭容器中加入CO、![]() 、
、![]() 、
、![]() 各
各![]() ,则此时
,则此时![]() ___________
___________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
(3)反应![]()
![]() 可用于捕捉空气中的
可用于捕捉空气中的![]() ,为研究温度对
,为研究温度对![]() 捕获
捕获![]() 效率的影响,在某温度
效率的影响,在某温度![]() 下,将一定量的
下,将一定量的![]() 溶液置于密闭容器中,并充入一定量的
溶液置于密闭容器中,并充入一定量的![]() 气体,在t时刻,测得容器中
气体,在t时刻,测得容器中![]() 气体的浓度。然后分别在温度为
气体的浓度。然后分别在温度为![]() 、
、![]() 、
、![]() 、
、![]() 下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定
下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定![]() 气体的浓度,得到的曲线图如下:
气体的浓度,得到的曲线图如下:

①![]() ____________
____________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。![]() 区间,
区间,![]() 变化的原因是_____________。
变化的原因是_____________。
②已知常温下![]() 的电离常数
的电离常数![]() ,碳酸的电离常数
,碳酸的电离常数![]() 、
、![]() ,则恰好完全反应时所得的
,则恰好完全反应时所得的![]() 溶液中
溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③在图中所示五种温度下,该反应的平衡常数最大的温度是____________。
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的不利影响。
(1)已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ/molS(l)+O2(g)=SO2(g) ΔH2=-296kJ/mol
一定条件下,可以通过CO与SO2反应生成S(1)和一种无毒的气体,实现燃煤烟气中硫的回收,写出该反应的热化学方程式_______________________________。
(2)在500℃下合成甲醇的反应原理为:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)
CH3OH(g)+H2O(g);在1L的密闭容器中,充入1mol CO2和3mol H2,压强为p0 kpa,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。(可逆反应的平衡常数可以用平衡浓度计算,也可以用平衡分压Kp代替平衡浓度,计算分压=总压×物质的量分数)

①0~4min,H2的平均反应速率v(H2)=________mol·L1·min1。
②CO2平衡时的体积分数为______________,该温度下Kp为_________kPa-2_(用含有p0的式子表示,小数点后保留1位)。
③下列能说明该反应已达到平衡状态的是______________。
A.v正(CH3OH)=3v逆(H2)
B.CO2、H2、CH3OH和H2O浓度之比为1∶3∶1∶1
C.恒温恒压下,气体的体积不再变化
D.恒温恒容下,气体的密度不再变化
④500℃、在2个容积都是2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器甲 | 容器乙 |
反应物起始投入量 | 1mol CO2,3mol H2 | 0.5mol CO2,1mol H2 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L1 | C1 | C2 |
则乙容器中反应起始向________(填“正反应”或“逆反应”)方向进行;c1_________(填“>”“<”或“=”)c2。