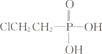题目内容
【题目】以炼锌烟尘(主要成分为 ZnO,含少量 CuO 和 FeO)为原料,制取氯化锌晶体(ZnCl2xH2O) 的工艺流程如下:
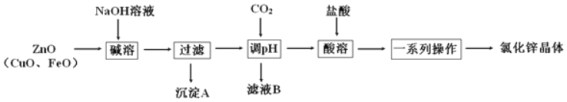 已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2﹣。
(1)“调 pH”步骤中通入过量 CO2 时发生反应的离子方程式为_____。
(2)下列说法正确的是_____。
A.加入过量 NaOH 溶液的目的是提高锌元素的浸取率
B.沉淀 A 主要成分是 CuO、FeO
C.洗涤沉淀时,直接将洗涤液加入漏斗,并用玻璃棒轻轻搅拌
D.利用结晶法可以从氯化锌溶液中获得氯化锌晶体
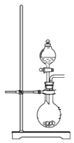
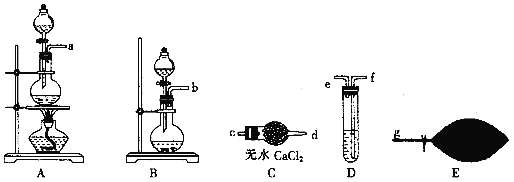
(3)氯化锌晶体(ZnCl2xH2O)是白色晶体,可含 1、1.5、2.5、3、4个结晶水,易潮解,易溶于水,溶于乙醇、丙酮。由氯化锌晶体制备无水氯化锌的装置如图,其中滴液漏斗中盛放的是 SOCl2(SOCl2 熔点为﹣105℃、沸点 78.8℃、遇水剧烈水解生成两种酸性气体)。
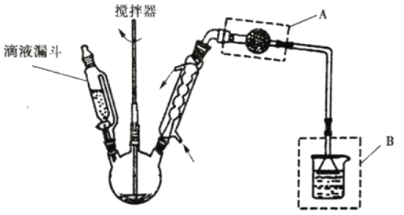
①下列物质中最适合洗涤氯化锌晶体的是_____。
A.冷水 B.浓盐酸 C.乙醇 D.氨水
②仪器 A 的名称为_____;装置 B 的作用是_____。
③以 ZnCl2H2O 为例,写出三颈烧瓶中发生反应的化学方程式_____
【答案】[Zn(OH)4]2﹣+2CO2=Zn(OH)2↓+2HCO3﹣ ABD C 干燥管 吸收尾气并防止倒吸 2ZnCl2H2O+SOCl2=2ZnCl2+2HCl+H2SO4
【解析】
(1)“调节pH”步骤中通入过量CO2时,[Zn(OH)4]2﹣与CO2反应,生成Zn(OH)2沉淀;
(2)A. 加入过量 NaOH 溶液,可使ZnO充分反应;
B. CuO、FeO与氢氧化钠溶液不反应;
C. 洗涤沉淀时,直接将洗涤液加入漏斗,不能用玻璃棒轻轻搅拌,防止滤纸破裂;
D. 利用结晶法从氯化锌溶液中获得氯化锌晶体,要注意应在氯化氢氛围中,可防止氯化锌水解;
(3)①洗涤氯化锌晶体的应避免晶体的溶解由此选择试剂;
②由装置图判断仪器名称;装置 B 为尾气吸收装置,同时还可防倒吸;
③三颈烧瓶中ZnCl2H2O与SOCl2反应,生成ZnCl2、HCl和H2SO4,据此书写方程式。
(1)“调节pH”步骤中通入过量CO2时,生成Zn(OH)2沉淀,发生反应的离子方程式为[Zn(OH)4]2﹣+2CO2=Zn(OH)2↓+2HCO3﹣;
(2)A. 加入过量 NaOH 溶液,可使ZnO充分反应,可提高锌元素的浸取率,A项正确;
B. CuO、FeO与氢氧化钠溶液不反应,因此沉淀 A 主要成分是 CuO、FeO, B项正确;
C. 洗涤沉淀时,直接将洗涤液加入漏斗,不能用玻璃棒轻轻搅拌,防止滤纸破裂,C项错误;
D. 利用结晶法从氯化锌溶液中获得氯化锌晶体,要注意应在氯化氢氛围中,可防止氯化锌水解,D项正确;
答案选ABD;
(3)①洗涤氯化锌晶体的应避免晶体的溶解,因此选择的试剂为乙醇,答案选C;
②由装置图可知A为干燥管;装置 B 为尾气吸收装置,同时还可防倒吸;
③三颈烧瓶中ZnCl2H2O与SOCl2反应,生成ZnCl2、HCl和H2SO4,反应方程式为:2ZnCl2H2O+SOCl2=2ZnCl2+2HCl+H2SO4。

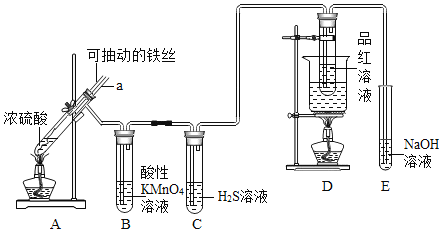
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是_____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。