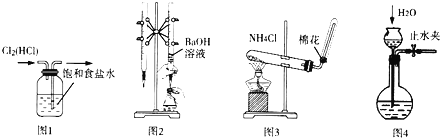
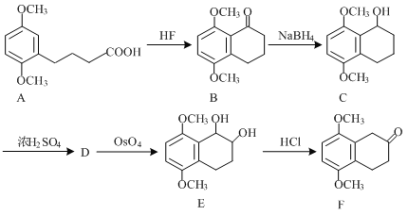
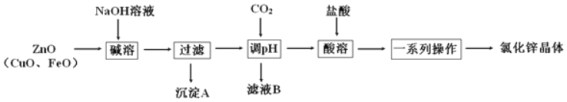
��Ŀ����
����Ŀ��X��Y��Z��Q��E����Ԫ���У�Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�Yԭ�Ӻ����L���������K���������Z�ǵؿ��ں���(��������)��ߵ�Ԫ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�������ش��������⣺
��1��X��Y��Ԫ�ط�������Ϊ___��___��
��2��XZ2��YZ2���ӵ����幹�ͷֱ���__��__����ͬ������������ˮ�е��ܽ�Ƚϴ����___(д����ʽ)��������__��
��3��Q��Ԫ�ط�����__�������ڵ�__���ڣ����ĺ�������Ų�ʽΪ__�����γɻ�����ʱ��������ϼ�Ϊ___��
��4���������ʾʽд��E���⻯����Һ�д��ڵ����������__��
���𰸡�S C V�� ֱ���� SO2 SO2Ϊ���Է��� Cr �� 1s22s22p63s23p63d54s1 +6 F-H��F��O-H��F��O-H��O��F-H...O
��������
Xԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ���X�ĺ�������Ų�ʽΪ1s22s22p63s23p4��XΪSԪ�أ�Yԭ�Ӻ����L���������K�����������Y��ԭ������Ϊ6��YΪCԪ�أ�Z�ǵؿ��ں���(��������)��ߵ�Ԫ�أ���ZΪOԪ�أ�Q�ĺ˵������X��Z�ĺ˵����֮�ͣ���Q�ĺ˵����Ϊ24��QΪCrԪ�أ�E��Ԫ�����ڱ��ĸ�Ԫ���е縺�������EΪFԪ�ء�
��1�����Ϸ�����X��Y��Ԫ�ط�������ΪS��C��
��2��XZ2��YZ2���ӷֱ�ΪSO2��CO2��SO2��S�ļ۵��Ӷ���Ϊ![]() ������Sԭ�Ӱ�sp2��ʽ�ӻ���S��O�γ�2���Ҽ�����һ���µ��Ӷԣ�ΪV�ͣ�CO2�У�C�ļ۲���Ӷ���Ϊ
������Sԭ�Ӱ�sp2��ʽ�ӻ���S��O�γ�2���Ҽ�����һ���µ��Ӷԣ�ΪV�ͣ�CO2�У�C�ļ۲���Ӷ���Ϊ![]() ������Cԭ�Ӱ�sp��ʽ�ӻ���C��O�γ�2���Ҽ���û�йµ��Ӷԣ�Ϊֱ���Σ�SO2�Ǽ��Է��ӣ�H2O�Ǽ��Է��ӣ���CO2�ǷǼ��Է��ӣ������������ܣ�SO2��ͬ������ˮ�е��ܽ�Ƚϴ�
������Cԭ�Ӱ�sp��ʽ�ӻ���C��O�γ�2���Ҽ���û�йµ��Ӷԣ�Ϊֱ���Σ�SO2�Ǽ��Է��ӣ�H2O�Ǽ��Է��ӣ���CO2�ǷǼ��Է��ӣ������������ܣ�SO2��ͬ������ˮ�е��ܽ�Ƚϴ�
��3�����Ϸ�����Q��Ԫ�ط�����Cr�������ڵ������ڣ����������Ϊ24�����������Ų�ʽΪ1s22s22p63s23p63d54s1������������Ϊ6�������γɻ�����ʱ��������ϼ�Ϊ+6�ۡ�
��4��HF��ˮ��Һ�У�F�ĵ縺�Խϴ�����һ�����ӵ�HF��ˮ�����е�H�γ�������ɱ�ʾΪF-H��F����ԭ�Ӻ�ˮ�����е���ԭ���γ�������ɱ�ʾΪO-H��F����ԭ����HF�����е���ԭ���γ�������ɱ�ʾΪF-H...O����ԭ�Ӻ���һ��ˮ�����е���ԭ�����γ�������ɱ�ʾΪO-H��O��

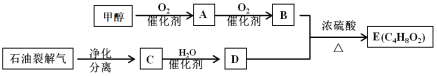
����Ŀ���й����������վ������ʾ��������![]() ��
��![]() Ϊ������������Ӱ�������������������Ⱦ�����Ҫ��ԴΪȼú��������β���ȡ���ˣ���
Ϊ������������Ӱ�������������������Ⱦ�����Ҫ��ԴΪȼú��������β���ȡ���ˣ���![]() ��
��![]() ��
��![]() �Ƚ����о�������Ҫ���塣��ش��������⣺
�Ƚ����о�������Ҫ���塣��ش��������⣺
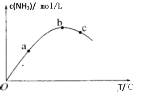
(1)��![]() ����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
����������ˮ�����Ƴɴ�������������ø���������ˮ���������ӵĻ�ѧ��ּ���ƽ��Ũ�����±���
���� |
|
|
|
|
|
|
Ũ�� |
|
|
|
|
|
|
���ݱ������ݼ���![]() ����������pH =___________��
����������pH =___________��
(2)��������������ʱ������![]() ��
��![]() ��Ӧ����β���п�������ʱ��
��Ӧ����β���п�������ʱ��![]() �ڴ�ת�����б���ԭ��
�ڴ�ת�����б���ԭ��![]() �ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ________��
�ų���д��NO��CO��ԭ�Ļ�ѧ����ʽ________��
(3)��ѭ�����ղ���������![]() ���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�
���ͻ�����Ⱦ��ͬʱ�����Ƶ������������������£�

�������ӷ���ʽ��ʾ��Ӧ���з����ķ�Ӧ_______��
���û�ѧƽ���ƶ���ԭ����������HI�ֽⷴӦ��ʹ��Ĥ��Ӧ�������![]() ��Ŀ����_______��
��Ŀ����_______��
(4)��ͼ����![]() �ѳ�������NO��ԭ����
�ѳ�������NO��ԭ����
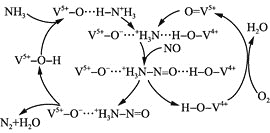
�ٸ�����ԭ���У�NO����ת��Ϊ ________![]() �ѧʽ
�ѧʽ![]() ��H2O��
��H2O��
�ڵ�����![]() ��
��![]() ʱ����ȥ��NO�ڱ�״���µ����Ϊ____L��
ʱ����ȥ��NO�ڱ�״���µ����Ϊ____L��
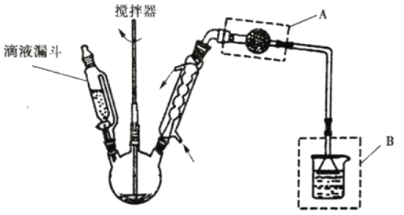
����Ŀ��A��B��C��D����ǿ����ʣ�������ˮ�е���ʱ�ɲ�����������(ÿ������ֻ��һ���������һ����ظ�)��
������ | Na����Ba2����NH4+ |
������ | CH3COO����Cl����OH����SO42- |
��֪����A��C��Һ��pH������7����ͬŨ��A��B����Һ��ˮ�ĵ���̶���ͬ����C��Һ��D��Һ����ʱֻ���ɰ�ɫ������B��Һ��C��Һ����ʱֻ���ɴ̼�����ζ�����壬A��Һ��D��Һ���ʱ����������
��1��A��___��B��___��
��2��д��C��D��Ӧ�����ӷ���ʽ___��
��3��25��ʱ��0.1mol��L��1B��Һ��pH��a����B��Һ��c(H��)��c(NH3��H2O)��___(�ú���a�Ĺ�ϵʽ��ʾ)��
��4����������������ʵ���Ũ�ȵ�B��Һ��C��Һ��ϣ���Ӧ����Һ�и�������Ũ���ɴ�С��˳��Ϊ___��
��5����һ�������0.005mol��L��1��C��Һ�У�����һ�������0.00125mol��L��1������ʱ�������Һ��pH��11������Ӧ����Һ���������C��Һ����������֮�ͣ���C��Һ��������������___��