题目内容
【题目】根据原子结构与性质的相关知识,请回答下列问题:
(1)基态S原子电子占据最高能层的符号是___________,最高能级的电子云轮廓图为___________形。
(2)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为_____、_____(填标号)。

(3)Fe3+基态核外电子排布式为___________
(4)根据元素周期律,原子半径As ________Se,电负性As________ Se (填“大于”或“小于”)
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是___________
【答案】M 哑铃(纺锤) D C [Ar]3d5或1s22s22p63s23p63d5 大于 小于 铜失去的是全充满的3d10电子,镍失去的是4s1电子
【解析】
(1)基态S原子电子占据的最高能层是M层,占据该能层的电子中能量最高的电子为3p电子,3p电子的电子云在空间有3个伸展方向,原子轨道为哑铃形;
(2)基态能量最低,处于激发态能量高;
(3)Fe3+基态核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5。
(4)根据元素周期律,同周期从左到右原子半径逐渐减小,电负性逐渐增大;
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子。
(1)基态S原子电子占据的最高能层是M层,占据该能层的电子中能量最高的电子为3p电子,3p电子的电子云在空间有3个伸展方向,且相互垂直,原子轨道为哑铃形;
(2)基态能量最低,处于激发态能量高,能量1s<2s<2p;能量最低和最高的分别为D、C;
(3)Fe3+基态核外电子排布式为[Ar]3d5或1s22s22p63s23p63d5。
(4)根据元素周期律,同周期从左到右原子半径逐渐减小,电负性逐渐增大;根据元素周期律,原子半径As 大于Se,电负性As小于Se ;
(5)元素铜与镍的第二电离能分别为:ICu=1958kJ·mol-1、INi=1753kJ·mol-1, ICu>INi的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子。

 快乐暑假暑假能力自测中西书局系列答案
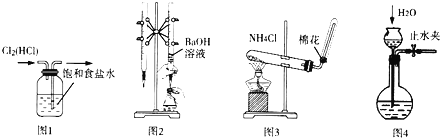
快乐暑假暑假能力自测中西书局系列答案【题目】下列有关物质的制备装置、制备时使用的原料与收集方法均正确的是( )
序号 | 物质 | 制备装置 | 制备时使用的原料 | 收集方法 | 序号 | 物质 | 制备装置 | 制备时使用的原料 | 收集方法 |
A |
|
|
| 排水法 | B | NO |
| 浓硝酸和金属铜 | 排空气法 |
C |
|
| 浓氨水和氢氧化钠固体 | 排空气法 | D |
|
| 乙醇和 | 排水法 |
A.AB.BC.CD.D