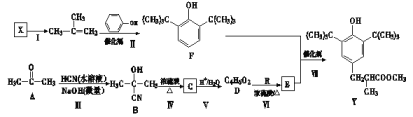
题目内容
【题目】Ⅰ.恒温恒容下,将2mol A气体和2mol B气体通入体积为2L的密闭容器中发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2 min时反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应至达到平衡状态,生成C的平均反应速率为_____ mol/(L·s)。
(2)x=____。
(3)下列各项可作为该反应达到平衡状态的标志的是____。
A.压强不再变化 B.v(A)正=2v(B)逆
C 气体密度不再变化 D.A的百分含量保持不变
E.A的消耗速率与C的消耗速率之比为2:1
Ⅱ.某鱼雷采用 Al-Ag2O 动力电池,以溶解有KOH 的流动海水为电解液,电池总反应为:2Al+3Ag2O+2KOH=6Ag+2KAlO2+H2O。试回答下列问题:
(1)Ag2O 为电池的____极(填“负”或“正”),负极反应式为______。
(2)当有 1mol电子流经外电路时,负极质量减少______g。
(3)溶液中的 OH-向________极迁移(填“Ag2O”或“Al”)。
【答案】0.01 3 BCD 正 Al+4OH--3e-=AlO2-+2H2O 9 Al
【解析】
I.(1)根据化学反应速率的概念计算v(C);
(2)根据速率比等于化学计量数的比,先计算出v(B),在计算x的值;
(3)根据平衡状态时正、逆反应速率相等,任何一组分的质量、物质的量及含量不变分析、判断;
II.在Al-Ag2O动力电池中,由于活动性Al>Ag2O,所以Al是负极,Ag2O是正极;阳离子向正极移动,阴离子向负极移动,在同一闭合回路中电子转移数目相等。
I.(1)v(C)=![]() =0.01mol/(L·s);
=0.01mol/(L·s);
(2) v(B)=![]() =
=![]() mol/(L·s),v(B):v(C)=1:x=
mol/(L·s),v(B):v(C)=1:x=![]() :0.01,解得x=3;
:0.01,解得x=3;
(3)A.该反应是反应前后气体体积不变的反应,无论反应是否平衡,气体的压强不变,因此不能根据压强不再变化判断反应是否处于平衡状态,A错误;
B.根据v(A)正=2v(B)逆可得v(A)正= v(A)逆,反应处于平衡状态,B正确;
C.该反应在反应前后气体的质量会发生变化,由于容器的容积不变,所以若气体密度不再变化,反应达到平衡状态,C正确;
D.若反应未达到平衡,A的质量就会发生变化,因此若A的百分含量保持不变,说明反应达到平衡状态,D正确;
E.根据方程式可知,每反应消耗2mol A,就会同时产生3mol C,若A的消耗速率与C的消耗速率之比为2:3,则会产生2mol A,反应达到平衡,现在A的消耗速率与C的消耗速率之比为2:1,说明反应未达到平衡状态,E错误;
故合理选项是BCD;
II.(1)电极活动性:Al>Ag2O,所以Ag2O为电池的正极,Al为负极,负极Al失去电子变为Al3+,与溶液中的OH-反应产生AlO2-,所以负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O。
(2)Al是+3价的金属,每有1mol Al反应,转移3mol电子,所以当有 1mol电子流经外电路时,负极质量减少了![]() =9g。
=9g。
(3)根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的 OH-向正电荷较多的负极Al电极迁移。

 天天练口算系列答案
天天练口算系列答案【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。
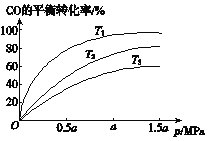
②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
【题目】在四支试管中发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,生成气体的速率最大的是( )
试管 | 温度/℃ | 等质量的CaCO3的形状 | 盐酸浓度/mol.L-1 |
A | 20 | 块状 | 0.5 |
B | 20 | 块状 | 1.0 |
C | 40 | 块状 | 1.0 |
D | 40 | 粉末 | 1.0 |
A.AB.BC.CD.D