题目内容
【题目】某学生为确定某烃的分子式及其可能的结构简式,做了如下实验,标准状况下,取0.1mol某烃,在氧气中完全燃烧,生成的二氧化碳体积为22.4L,同时得到16.2g水。
(1).该烃的摩尔质量为________。
(2).该烃的分子式为________。
(3).该烃有一种可能的结构为 ,其名称为________。
,其名称为________。
(4). 属于________(选填序号)。
属于________(选填序号)。
a.环烃 b.烷烃 c.芳香烃 d.不饱和烃
【答案】138g/molC10H184,5-二甲基-3-乙基-1-环己烯a、d
【解析】
设该烃分子式CxHy;则燃烧方程式为:CxHy+![]() O2
O2 ![]() xCO2+
xCO2+![]() H2O;
H2O;
生成的CO2物质的量=![]() =1mol;生成水的物质的量=
=1mol;生成水的物质的量=![]() =0.9mol;
=0.9mol;
0.1mol该烃燃烧生成1molCO2,0.9molH2O;
CxHy+![]() O2
O2 ![]() xCO2+
xCO2+![]() H2O;
H2O;
0.1 1 0.9;
1:x:![]() =0.1:1:0.9;(化学计量数之比等于物质的量之比);x=10,y=18;所以(1).该烃的摩尔质量为(12
=0.1:1:0.9;(化学计量数之比等于物质的量之比);x=10,y=18;所以(1).该烃的摩尔质量为(12![]() )g/mol =138g/mol;(2).该烃的分子式为C10H18;(3).
)g/mol =138g/mol;(2).该烃的分子式为C10H18;(3). 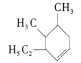 根据烯烃的命名,分子中六元环中有一个碳碳双键,4,5号碳上各含有一个甲基,3号碳上含有一个乙基,故其名称为4,5-二甲基-3-乙基-1-环己烯;(4).
根据烯烃的命名,分子中六元环中有一个碳碳双键,4,5号碳上各含有一个甲基,3号碳上含有一个乙基,故其名称为4,5-二甲基-3-乙基-1-环己烯;(4).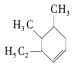 属于含有一个碳碳双键且含有一个环状结构,分子中只含有碳氢两种元素,属于环状烯烃,为不饱和烃,不含苯环,不属于芳香烃,答案选a、d。
属于含有一个碳碳双键且含有一个环状结构,分子中只含有碳氢两种元素,属于环状烯烃,为不饱和烃,不含苯环,不属于芳香烃,答案选a、d。

【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
【题目】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
温度/℃ | 250 | 600 | 1000 | 2000 |
主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为_____________(填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________(设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 |
x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K = ____________(保留1位小数)。达到平衡时CO的转化率为___________。

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________。图中显示其它条件固定时,增加压强会导致平衡向___________(填“左”或“右”)移动。
【题目】在四支试管中发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,生成气体的速率最大的是( )
试管 | 温度/℃ | 等质量的CaCO3的形状 | 盐酸浓度/mol.L-1 |
A | 20 | 块状 | 0.5 |
B | 20 | 块状 | 1.0 |
C | 40 | 块状 | 1.0 |
D | 40 | 粉末 | 1.0 |
A.AB.BC.CD.D

