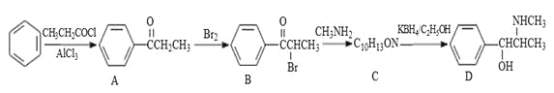
题目内容
【题目】已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。
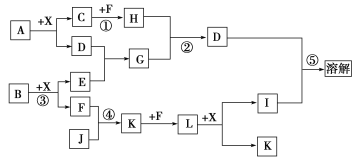
(1)写出化学式:A________,B________,J________;
(2)反应③中每生成1 mol F,转移电子的数目为______________;
(3)反应④的化学方程式为:______________________________;
(4)写出离子方程式:反应②________________________________,反应⑤________________________________________________。
【答案】Al4C3 Na2O2 NH3 2NA 4NH3+5O2![]() 4NO+6H2O 2AlO2-+CO2+3H2O=Al(OH)3↓+CO32-(CO2少量)或者AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(CO2过量) Al(OH)3+3H+=Al3++3H2O
4NO+6H2O 2AlO2-+CO2+3H2O=Al(OH)3↓+CO32-(CO2少量)或者AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(CO2过量) Al(OH)3+3H+=Al3++3H2O
【解析】
B是一种淡黄色固体,即B是Na2O2,能与过氧化钠反应的物质为CO2和H2O,X为常见的无色液体,即X为H2O,过氧化钠与H2O反应生成NaOH和O2,C是含氢量最高的烃,即C为CH4,C、J是同周期元素的气态氢化物,即J为NH3,E为NaOH,F为O2,K为NO,L为NO2,I为HNO3,反应⑤后是溶解,则D为溶于硝酸的沉淀,反应①为甲烷的燃烧,即H为CO2,能与NaOH反应生成沉淀,大胆猜测为Al(OH)3,则G为NaAlO2,CO2能与AlO2-反应生成Al(OH)3,根据元素守恒,推出A中含有的元素为Al和C,A的化学式为Al4C3,其中Al元素质量分数为75%,C的质量分数为25%,符合题意,据此分析。
(1)根据上述分析,A为Al4C3,B为Na2O2,J为NH3;
(2)反应③为2Na2O2+2H2O=4NaOH+O2↑,生成1molO2,转移电子物质的量为2mol,即转移电子数目为2NA;
(3)反应④为氨气的催化氧化,化学反应方程式为4NH4+5O2![]() 4NO+6H2O;
4NO+6H2O;
(4)反应②离子方程式为2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-(CO2少量)或者AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-(CO2过量);反应⑤的离子方程式为Al(OH)3+3H+=Al3++3H2O。

 名校课堂系列答案
名校课堂系列答案