题目内容
3.欲配制100mL 1.0mol/L Na2SO4溶液,正确的方法是( )(已知Na2SO4、Na2SO4•10H2O的式量分别为142和322)
①将14.2g Na2SO4溶于100mL水中
②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100mL
③将20mL5.0mol/L Na2SO4溶液用水稀释至100mL.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ①②③ |
分析 欲配制100mL 1.0mol/L Na2SO4溶液,需要硫酸钠的质量为:1.0mol/L×0.1L×142g/mol=14.2g;
需要Na2SO4•10H2O的质量为1.0mol/L×0.1L×322g/mol=32.2g,
溶于水配成100mL溶液,据此解答.
解答 解:①将14.2g Na2SO4溶于100mL水中,溶液的体积大于100mL,溶液的物质的量浓度小于1.0mol/L,故错误;
②32.2g Na2SO4•10H2O物质的量为0.1mol,溶于100mL水中,得到溶液的体积为100ml,溶液的物质的量浓度为0.1mol÷0.1L=1.0mol/L,故正确;
③设稀释后硫酸钠溶液浓度为c,根据稀释定律,稀释前后溶质硫酸钠的物质的量不变,则20ml×5mol/L=100ml×c,解得c=1mol/L,故正确;
故选:C.
点评 本题考查了配制一定物质的量浓度溶液,熟悉配制原理和过程是解题关键,注意溶液的体积与溶剂体积的差别,题目不难.

练习册系列答案
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案
相关题目
13.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=H2O+SO32-.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-
假设2:既不存在SO32-,也不存在ClO-;
假设3:两种离子都存在(或者 只存在ClO-);.
②要证明假设1是否成立,设计实验方案,进行实验.请写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
(1)请写出SO2与过量NaOH溶液反应的离子方程式:SO2+2OH-=H2O+SO32-.
(2)吸收尾气(Cl2)一段时间后,吸收液(强碱性)中肯定存在的阴离子有OH-和Cl-、SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响)
①提出合理假设.
假设1:只存在SO32-
假设2:既不存在SO32-,也不存在ClO-;
假设3:两种离子都存在(或者 只存在ClO-);.
②要证明假设1是否成立,设计实验方案,进行实验.请写出实验以及预期现象和结论.限选实验试剂:3mol•L-1H2SO4、1mol•L-1NaOH、0.01mol•L-1KMnO4、淀粉-KI溶液.
| 实验 | 预期现象和结论 |
| 取少许吸收液于试管中滴加1~2滴0.01mol•L-1KMnO4溶液 | 若溶液褪色则假设1成立,否则假设1不成立 |
11.在密闭容器内放入5molH2和5molN2,在某温度下经过反应生成2molNH3,此时密闭容器内压强是反应前压强的( )
| A. | 2倍 | B. | 1.5倍 | C. | 0.8倍 | D. | 0.5倍 |
18.下列物质中既能跟氢氧化钠反应又能跟盐酸反应的是( )
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al.
| A. | ③④ | B. | ②③④ | C. | ①③④ | D. | 全部 |
13.下列有关实验操作错误的是( )
| A. | 用药匙取用粉末状或小颗粒状固体 | |
| B. | 用胶头滴管滴加少量液体 | |
| C. | 给盛有2/3体积液体的试管加热 | |
| D. | 过滤时漏斗的下端管口要紧靠烧杯内壁 |
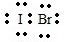 ,它是由极性共价键形成的极性分子.
,它是由极性共价键形成的极性分子.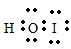 .
.
 .(不用写反应条件)
.(不用写反应条件)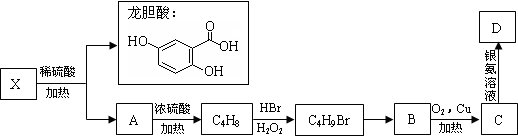
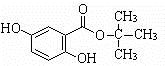 .
.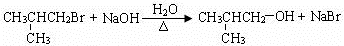 .(用结构简式表示)
.(用结构简式表示)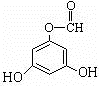 或
或 .
.