题目内容
标准状况下,将充满O2和NO2混合气体的试管倒置于水中,液体完全充满试管。此时试管内溶液中溶质的物质的量浓度是
| A.0.045 mol/L | B.0.036 mol/L | C.0.026 mol/L | D.0.028 mol/L |
B
解析试题分析:O2、NO2及水中,完全反应的化学方程式为:4NO2+O2+2H2O=4HNO3。反应后的溶质为硝酸。它的物质的量与二氧化氮的物质的量相等。假设试管的容积为VL,则二氧化氮的体积是(4/5)VL,n(NO2)=(4/5)VL÷22.4L/mol.反应后溶液的体积是Vl.所以C(HNO3)="n/V={(4/5)VL÷22.4L/mol}/VL=(1/28)" mol/L.=" 0.036" mol/L.
考点:考查O2和NO2混合气体与水的反应及溶液浓度的计算的知识。

同温同压下,质量忽略不计的两气球A和B,分别充入X气体和Y气体,且充气后两气球的体积相同.若相同条件下,A气球放在CO中静止不动,B气球放在O2中上浮.下列叙述或表示正确的是( )
| A.X气体的相对分子质量比Y气体的相对分子质量大 |
| B.X可能是N2,Y可能是CH4 |
| C.X气体的密度小于Y气体的密度 |
| D.充气后A气球质量比B气球质量大 |
已知等体积的20%硫酸溶液其质量大于10%硫酸溶液,则将溶质的质量分数为a%、物质的量浓度为C1 mol·L-1的稀硫酸加热蒸发掉溶液总质量的一半的水,此时溶质的质量分数变为b%,物质的量浓度为C2 mol·L-1,下列关系正确的是
| A.b﹤2 a | B.C2﹤2 C1 | C.C2﹥2 C1 | D.C1="2" C2 |
下列化学用语使用正确的是
A.Mg2+结构示意图: |
B.质子数为92,中子数为146的U原子: |
C.NH4Cl的电子式: |
D.四氯化碳分子球棍模型:  |
设NA为阿伏加德罗常数的数值,下列叙述正确的是
A.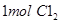 与足量Fe反应转移电子数一定为3NA 与足量Fe反应转移电子数一定为3NA |
| B.标准状况下,22.4L NH3中含有共价键的数目为NA |
C.1.0L 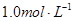 的 的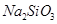 水溶液中含有的氧原子数为3NA 水溶液中含有的氧原子数为3NA |
D.4.6g Na完全转化成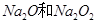 的混合物,混合物中阴离子总数为0.1NA 的混合物,混合物中阴离子总数为0.1NA |
下列化学用语的理解正确的是
A.离子结构示意图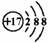 :可以表示35Cl-,也可以表示37Cl- :可以表示35Cl-,也可以表示37Cl- |
B.电子式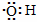 :可以表示羟基,也可以表示氢氧根离子 :可以表示羟基,也可以表示氢氧根离子 |
C.比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 |
D.聚丙烯的结构简式: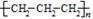 |
足量铜粉与一定量的浓硝酸充分反应,得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好沉淀完全,则消耗 NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
| A.0.1mol | B.0.5mol | C.0.15mol | D.0.25mol |