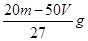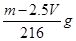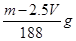题目内容
已知等体积的20%硫酸溶液其质量大于10%硫酸溶液,则将溶质的质量分数为a%、物质的量浓度为C1 mol·L-1的稀硫酸加热蒸发掉溶液总质量的一半的水,此时溶质的质量分数变为b%,物质的量浓度为C2 mol·L-1,下列关系正确的是
| A.b﹤2 a | B.C2﹤2 C1 | C.C2﹥2 C1 | D.C1="2" C2 |
C
解析试题分析:硫酸溶液的浓度越大,密度越大,则溶液的质量减小一半,蒸发后溶液的体积小于原来的一半。根据溶液蒸发前后溶质的物质的量可知,稀硫酸加热蒸发掉溶液总质量的一半的水时,溶液的质量分数将变为原来的2倍,即b=2a。设原溶液1 L,则n(H2SO4)=1 L×c1 mol?L-1=c1 mol。设溶液的质量为1000ρ1,蒸发掉水后,溶液质量为1000ρ1÷2=500ρ1,故溶液的体积为500ρ1÷ρ2=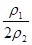 L,因此c2=
L,因此c2=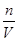 =
=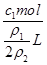 =2c1×
=2c1×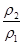 mol/L。因为ρ2>ρ1,所以则c2>2c1,答案选C。
mol/L。因为ρ2>ρ1,所以则c2>2c1,答案选C。
考点:考查质量分数、物质的量浓度以及溶液稀释的有关计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA为阿伏伽德罗常数的数值,下列说法正确的是
| A.5.6g Fe与足量稀盐酸反应转移的电子数为0.3NA |
| B.常温常压下,23g NO2含有NA个氧原子 |
| C.标准状况下,22.4L水含有个NAH2O分子 |
| D.1mol/L NaCl溶液含有NA个Na+ |
某溶液中含有Na+、Al3+、Cl—、SO42—四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和SO42—的离子个数比为( )。
| A.1:4 | B.1:2 | C.3:4 | D.3:2 |
下列化学用语正确的是
A.聚丙烯的结构简式: |
B.丙烷分子的比例模型: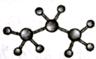 |
C.四氯化碳分子的电子式: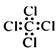 |
D.中子数为18的氯原子: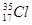 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.25°C时,1L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA |
| B.室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2.0NA |
| C.0.1mol Fe在0.1mol Cl2中充分燃烧,转移的电子数为0.3NA |
| D.标准状况下,22.4LCCl4中含有的分子数目为NA |
标准状况下,将充满O2和NO2混合气体的试管倒置于水中,液体完全充满试管。此时试管内溶液中溶质的物质的量浓度是
| A.0.045 mol/L | B.0.036 mol/L | C.0.026 mol/L | D.0.028 mol/L |
1 LAl2(SO4)3溶液中含有Al3+216g,取250ml溶液稀释到4L,则稀释后溶液中SO42-的物质的量浓度是
| A.0.25mol/L | B.0.5mol/L | C.0.75mol/L | D.1mol/L |