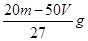题目内容
足量铜粉与一定量的浓硝酸充分反应,得到硝酸铜溶液和 NO2、N2O4、NO 的混合气体,将这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol/L NaOH溶液至Cu2+恰好沉淀完全,则消耗 NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
A
解析试题分析:铜粉和浓硝酸发生反应生成氮的氧化物,在反应过程中,铜失去电子给了硝酸,而这些氮的氧化物又跟氧气起反应,生成硝酸,这个过程中,氮的氧化物失去电子都给了氧,整个过中相当于是铜把电子失去被氧气得到的一个过程。在反应中氧气所得到的电子的物质的量为: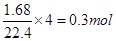
那么铜在反应过程中总共就失去了0.3mol的电子。
Cu-2e-=Cu2+
Cu2++2OH-=Cu(OH)2↓
从这两个过程中可以看出,铜所失去的电子的物质的量,与铜离子与碱反应生成氢氧化铜沉淀时所用掉的氢氧根离子的物质的量相等,即n(OH-)=0.3mol
则消耗 NaOH溶液的体积是: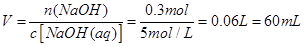
考点:守恒。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
标准状况下,将充满O2和NO2混合气体的试管倒置于水中,液体完全充满试管。此时试管内溶液中溶质的物质的量浓度是
| A.0.045 mol/L | B.0.036 mol/L | C.0.026 mol/L | D.0.028 mol/L |
下列选项中所涉及的两个量一定相等的是
| A.11.2 L N2与14 g CO气体所含有的原子数 |
| B.电解精炼铜时阳极溶解与阴极析出的铜的质量 |
| C.6.2 g Na2O和7.8 g Na2O2中所含的离子数 |
| D.18 g重水(D2O)与17 g NH4+所含有的电子数 |
关于2mol二氧化碳的叙述中,正确的是( )
| A.质量为44g | B.有4mol原子 |
| C.分子数为6.02×1023 | D.摩尔质量为44g/mol |
下列说法正确的是( )
| A.某液体的摩尔质量大于18g/mol,则该物质的密度一定比水大 |
| B.同温同压下,分别将充满HCl、NO2的两支试管倒立于蒸馏水中足够长时间,假设不考虑溶质的扩散,两支试管中溶液的物质的量的浓度之比为3:2 |
| C.将90%硫酸溶液和10%硫酸溶液等体积混合,其质量分数小于50% |
D.c mol/L的KCl溶液的密度为d g/mL,则此KCl溶液的质量分数为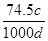 ×100% ×100% |
1 LAl2(SO4)3溶液中含有Al3+216g,取250ml溶液稀释到4L,则稀释后溶液中SO42-的物质的量浓度是
| A.0.25mol/L | B.0.5mol/L | C.0.75mol/L | D.1mol/L |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1 mol羟基所含的电子总数为10NA |
| B.标准状况下,1L正戊烷完全燃烧所生成的CO2分子数为5NA/22.4 |
| C.4.2g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| D.1 mol碳正离子(CH3+)所含的电子总数为8NA |