题目内容
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5mol,Mg2+为0.5mol,则SO42-的物质的量为 ( )
| A.0.1mol | B.0.5mol | C.0.15mol | D.0.25mol |
B
解析试题分析:因溶液中的离子有K+、Cl-、Mg2+、SO42,设SO42-物质的量为n,溶液不显电性,溶液中的阳离子带电的总电荷量与阴离子所带电的总电荷量相等,根据电荷守恒:1.5mol×1+0.5mol×2=1.5mol×1+n×2,解得n=0.5mol。
考点:物质的量的相关计算

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
标准状况下,将充满O2和NO2混合气体的试管倒置于水中,液体完全充满试管。此时试管内溶液中溶质的物质的量浓度是
| A.0.045 mol/L | B.0.036 mol/L | C.0.026 mol/L | D.0.028 mol/L |
下列说法正确的是( )
| A.某液体的摩尔质量大于18g/mol,则该物质的密度一定比水大 |
| B.同温同压下,分别将充满HCl、NO2的两支试管倒立于蒸馏水中足够长时间,假设不考虑溶质的扩散,两支试管中溶液的物质的量的浓度之比为3:2 |
| C.将90%硫酸溶液和10%硫酸溶液等体积混合,其质量分数小于50% |
D.c mol/L的KCl溶液的密度为d g/mL,则此KCl溶液的质量分数为 ×100% ×100% |
1 LAl2(SO4)3溶液中含有Al3+216g,取250ml溶液稀释到4L,则稀释后溶液中SO42-的物质的量浓度是
| A.0.25mol/L | B.0.5mol/L | C.0.75mol/L | D.1mol/L |
同温同压下,相同体积的下列气体,质量最大的是
| A.O2 | B.CH4 | C.CO2 | D.H2S |
下列叙述中正确的是
①标准状况下,1 L HCl和1 L H2O的物质的量相同;
②标准状况下,1 g H2和14 g N2的体积相同;
③28 g CO的体积为22.4 L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤在同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比。
| A.①②③ | B.②⑤⑥ | C.②③⑥ | D.②④⑤ |
由以下两种途径制铜:(1)CuO CuSO4
CuSO4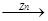 Cu (2)Zn
Cu (2)Zn H2
H2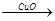 Cu 假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是
Cu 假设每一步反应都完全,要制得等质量的铜,两个途径相比较,下列有关说法正确的是
| A.消耗等物质的量的Zn、H2SO4、CuO |
| B.所有反应类型都相同 |
| C.过程中产生的ZnSO4质量相同 |
| D.只有CuO消耗的质量相同 |
设NA为阿伏加德罗常数的值,下列有关叙述正确的是
| A.1 mol羟基所含的电子总数为10NA |
| B.标准状况下,1L正戊烷完全燃烧所生成的CO2分子数为5NA/22.4 |
| C.4.2g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
| D.1 mol碳正离子(CH3+)所含的电子总数为8NA |
下列叙述正确的是( )
| A.同温同压下,相同体积的物质,其物质的量一定相等 |
| B.任何条件下,等体积的甲烷和一氧化碳所含的分子数一定相等 |
| C.1L一氧化碳气体一定比1L氧气的质量小 |
| D.相同条件下的一氧化碳气体和氮气,若体积相等,则质量一定相等 |