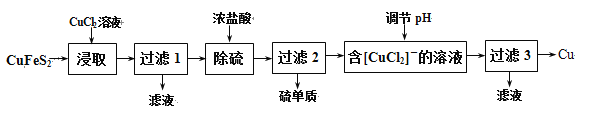
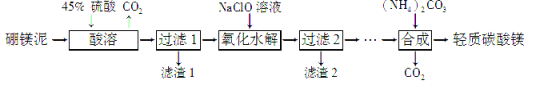
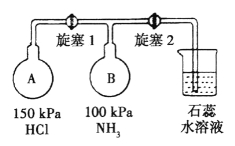
题目内容
【题目】(1)S2-、Fe2+、Fe3+、Mg2+、S、I-、H+,其中只有氧化性的是 ,只有
还原性的是 ,既有氧化性又有还原性的是 。
(2)氧化还原反应3S+6KOH=K2S+K2SO3+3H2O中,氧化产物是 ,该反应的
离子方程式为: 。
(3)已知 F是氧化性最强的元素,在与其他元素化合时只表现出负价,在3BrF3+5H2O=Br2+HBrO3+O2↑+9HF反应中,若有27克H2O参加反应,则被水还原的BrF3的分子数为 。
【答案】(1)Fe3+、Mg2+、H+;S2-、I-;Fe2+、S
(2)K2SO3;3S+6OH-=2S2-+SO32-+3H2O(3)0.4NA
【解析】
试题分析:元素处于最高价时只有氧化性,其中只有氧化性的是Fe3+、Mg2+、H+;元素处于最低价时只有还原性,只有还原性的是S2-、I-;元素处于中间价时既有氧化性又有还原性,既有氧化性又有还原性的是Fe2+、S;(2)氧化还原反应3S + 6KOH = K2S + K2SO3 + 3H2O中,元素化合价升高得到的产物是氧化产物,氧化产物是K2SO3,该反应的离子方程式为3S+6OH-=2S2-+SO32-+3H2O。(1)根据方程式3BrF3+5H2O=Br2+HBrO3+O2↑+9HF,当有5mol水参加反应时,O元素化合价由-2价升高到0价,2mol水被氧化,失去4mol电子,Br元素化合价由+3价降低到0价,则由H2O还原的BrF3为![]() mol,若有27克H2O参加反应,则被水还原的BrF3的物质的量为x,则
mol,若有27克H2O参加反应,则被水还原的BrF3的物质的量为x,则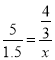 ,x=0.4mol,分子数为0.4NA。
,x=0.4mol,分子数为0.4NA。

练习册系列答案
相关题目