题目内容
【题目】滴定法是分析化学中常用实验方法,请根据滴定法的有关知识回答下列问题:
Ⅰ、某学生用0.1 mol·L-1 的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上1~2cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度.
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)_________AF。
(2)上述B步骤操作的目的是______________。
(3)在进行C步操作滴定前排气泡时,应选择下图2中的__________(填序号),若用25mL滴定管进行实验,当滴定管中的液面在“10”处,则管内液体的体积(填序号)__________(①=10mL,②=15mL,③<10mL,④>15mL)。

(4)判断以下操作,对测定结果盐酸浓度的影响(填“偏高”、“偏低”或““无影响”)
①上述A步骤操作之前,若先用待测溶液润洗锥形瓶,则对滴定结果的影响是_________。
②若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是___________。
③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将____________。
Ⅱ、氧化还原滴定法实际生产中运用较为广泛的方法。制备纳米TiO2的方法之一是TiCl4在加热条件下水解生成TiO2·xH2O,经过过滤、水洗除去其中的Cl-,再经烘干、焙烧除去水分,最后得到粉体TiO2。
可用氧化还原滴定法测定TiO2的质量分数。在一定条件下,将粉体溶解并将溶液中的Ti2-氧化为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。【注:NH4Fe(SO4)2是一种复盐,含有两种阳离子】。请回答下列问题:
(1)TiCl4水解生成TiO2·xH2O的化学方程式为_______________________。
(2)配制NH4Fe(SO4)2标准溶液时,加入一定量稀H2SO4的原因是____________________,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需用到图中的______________(填序号)
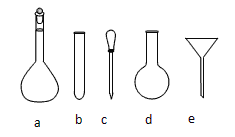
检验TiO2·xH2O中Cl-是否被除净的方法是________________________。
(3)滴定终点的现象是:当滴入最后一滴NH4Fe(SO4)2标准溶液时_______________________。
(4)滴定分析时,称取TiO2(摩尔质量为M g·mol-1)粉体试样wg,消耗v ml c mol·L-1 NH4Fe(SO4)2标准溶液。则TiO2质量分数表达式为___________________。
【答案】I.(各1分)(1)BDCE(1分);
(2)防止标准溶液被稀释,引起误差
(3)③ ④
(4)①偏高 ②偏低③偏低
II.(1)TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl(2分)
TiO2·xH2O↓+4HCl(2分)
(2)抑制NH4Fe(SO4)2的水解(1分) ac(1分)
取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净
(3)溶液立即变成浅红色(或红色),且半分钟内不褪色(2分)(4) ![]() (2分)
(2分)
【解析】
试题分析:I.(1)操作的步骤是选择滴定管,然后洗涤、装液、使尖嘴充满溶液、固定在滴定台上,然后调节液面记下读数.再取待测液于锥形瓶,然后加入指示剂进行滴定,所以顺序为:B、D、C、E、A、F,故答案为:B、D、C、E;
(2)滴定管用蒸馏水洗涤后,内壁有一层水膜,如果直接装液会使浓度降低,所以必须用标准溶液润洗滴定管2-3次,故答案为:洗去附在滴定管壁上的水,防止因将标准液稀释而带来误差;
(3)碱式滴定管滴定前排气泡时,应使橡胶管弯曲,尖嘴向上排除气泡,选择图2中的③;若用25mL滴定管进行实验,当滴定管中的液面在“10”处,因滴定管25.00mL刻度下方还有溶液,则管内液体的体积>15mL,选④。
(4)①锥形瓶用蒸馏水洗涤后,如果再用待测液润洗,会使锥形瓶内溶质的物质的量增大,会造成V(碱)偏大,根据c(酸)=![]() ,会造成结果偏高,②如所用KOH含有少量NaOH,则会使结果偏小,因为同质量的NaOH比KOH中和能力强,所需溶液的体积少,所以偏低。③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则加入的待测液体积偏小,导致需要的标准液体积偏小,结果偏低。
,会造成结果偏高,②如所用KOH含有少量NaOH,则会使结果偏小,因为同质量的NaOH比KOH中和能力强,所需溶液的体积少,所以偏低。③如果滴定前装有待测溶液的酸式滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则加入的待测液体积偏小,导致需要的标准液体积偏小,结果偏低。
II.(1)设TiCl4的系数为1,根据元素守恒,TiO2·xH2O的系数为1,HCl的系数为4;再根据O元素守恒,可知H2O的系数为(2+x),反应为TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl,故答案为:TiCl4+(x+2)H2O
TiO2·xH2O↓+4HCl,故答案为:TiCl4+(x+2)H2O![]() TiO2·xH2O↓+4HCl;
TiO2·xH2O↓+4HCl;
(2)铁离子水解,应抑制水解,不引入杂质,则加硫酸抑制NH4Fe(SO4)2水解,配制溶液用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需ac;沉淀吸附溶液中的Cl-,根据发生反应:Cl-+Ag+═AgCl↓,取少量洗涤液,检验溶液中溶解的离子是否还存在,故答案为:取少量水洗液,滴加AgNO3溶液,不产生白色沉淀,说明Cl-已除净;
(3)Fe3+与Ti3+反应,被还原为Fe2+,加入KSCN不显红色,当达到滴定终点时,再加入NH4Fe(SO4)2,溶液中Fe3+过量,溶液立即变成浅红色(或红色),且半分钟内不褪色,故答案为:溶液立即变成浅红色(或红色),且半分钟内不褪色;
(4)根据得失电子守恒,有:1Ti3+~1Fe3+,故n(Fe3+)=n(Ti3+)=n(TiO2)=cV×10-3mol,其质量分数为![]() 或
或 ![]() %,故答案为:
%,故答案为:![]() 或
或![]() %。
%。

