题目内容
【题目】金属及其化合物在生产中用途广泛。
Ⅰ.从含铜丰富的自然资源黄铜矿(CuFeS2)冶练铜的工艺流程如下:
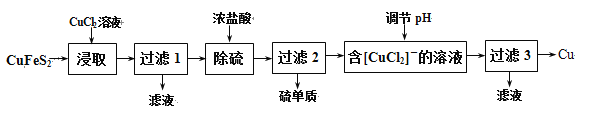
已知:CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓
(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为 。
(2)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为 。
(3)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是 。(填离子符号)
(4)过滤3所得滤液中可以循环使用的物质有 ,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为 。
Ⅱ.利用生产硼砂的废渣——硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:
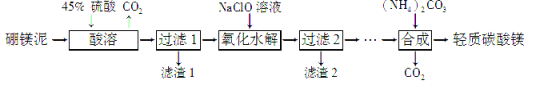
(1) 写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式 。
(2) 滤渣2的主要成分有MnO2和_____________,写出生成MnO2的离子方程式____________________。
(3)“合成”时需通蒸汽至80 ℃,边加热边搅拌,温度控制在80 ℃的原因是________________________(只需写出相应的化学方程式)。
【答案】Ⅰ.(1)CuFeS2+3FeCl3=CuCl↓+4FeCl2+2S↓(2分)
(2)Fe2O3(1分)(3)Cu2+(1分)
(4)HCl和CuCl2(2分),0.5mol(2分)
Ⅱ.(1)MgCO3+2H+=Mg2++H2O+CO2↑(1分)
(2)Fe(OH)3(1分)Mn2++ClO-+H2O=MnO2↓+2H++Cl-(2分)
(3)(NH4)2CO3![]() 2NH3↑+H2O+CO2↑(2分)
2NH3↑+H2O+CO2↑(2分)
【解析】
试题分析:Ⅰ.(1)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为 CuFeS2 + 3FeCl3=CuCl↓+ 4FeCl2 + 2S↓。
(2)滤液中只含FeCl2,存在Fe2++2H2O![]() Fe(OH)2+2H+,加热促进水解,Fe(OH)2在空气中易氧化生成Fe(OH)3,生成的Fe(OH)3受热分解,最终所得固体的化学式为Fe2O3。
Fe(OH)2+2H+,加热促进水解,Fe(OH)2在空气中易氧化生成Fe(OH)3,生成的Fe(OH)3受热分解,最终所得固体的化学式为Fe2O3。
(3)+1价的Cu在酸性条件下发生歧化反应,生成0价和+2价铜,故调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是Cu2+;
(4)过滤3所得滤液中含有HCl和CuCl2,可以循环使用,每生成1molCu,理论上需补充CuCl2的物质的量为0.5mol。
Ⅱ.由制备流程可知,硼镁泥的主要成分为MgCO3、SiO2,还有少量Fe2O3、MnO、CaO等,向废渣中加硫酸时SiO2不溶解,过滤得到滤渣1为二氧化硅,NaClO具有氧化性,能将Mn2+氧化为MnO2,调节pH生成MnO2、Fe(OH)3沉淀,过滤得滤渣2为MnO2、Fe(OH)3,再经过系列除杂后所得溶液中加碳酸铵溶液,得到轻质碳酸镁,则
(1)MgCO3和硫酸反应生成硫酸镁和二氧化碳,反应方程式为MgCO3+2H+=Mg2++H2O+CO2↑;
(2)根据上面的分析可知滤渣2的主要成分为MnO2、Fe(OH)3,次氯酸钠能氧化锰离子生成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(3)“合成”时在溶液中加碳酸铵溶液,得到轻质碳酸镁、硫酸铵和水,温度过低反应速率慢,温度过高轻质碳酸镁、碳酸铵会分解,反应的方程式为(NH4)2CO3 ![]() 2 NH3↑+H2O + CO2↑。
2 NH3↑+H2O + CO2↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案