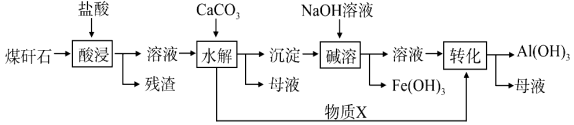
题目内容
【题目】NH3及其盐都是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为_____________。

(2)按下图装置进行NH3性质实验。
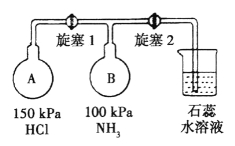
①先打开旋塞1,B瓶中的现象是_______________,原因是____________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_____________。
(3)设计实验,探究某一种因素对溶液中NH4Cl水解程度的影响。
限制试剂与仪器:固体NH4Cl、蒸馏水、100mL容量瓶、烧杯、胶头滴管、玻璃棒、药匙、天平、PH计、温度计、恒温水浴槽(可控制温度)
①实验目的:探究对溶液中NH4Cl水解程度的影响。
②设计实验方案,拟定实验表格,完整体现实验方案(列出能直接读取数据的相关物理量及需拟定的数据,数据用字母表示;表中V(溶液)表示所配制溶液的体积)。

③按实验序号I所拟数据进行实验,若读取的待测物理量的数值为Y,则NH4Cl水解反应得平衡转化率为______________ (只列出算式,忽略水自身电离的影响)。
【答案】
(1)ACG;(2)①产生白色的烟;氯化氢与氨气反应生成了氯化铵小颗粒,氯化铵小颗粒形成白烟。②烧杯中的石蕊溶液会倒流进入到B瓶中,溶液显红色。
(3)①温度(或浓度)
②温度的影响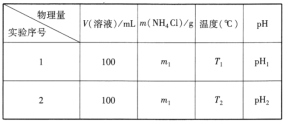
(浓度的影响)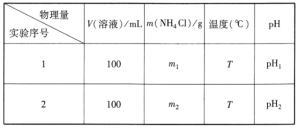
③(5.35×10-Y)/m1×100%
【解析】
试题分析:(1)实验室用加热固体氯化铵和熟石灰制取氨气(2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,因防止药品中的湿存水以及反应产生的水使反应试管受热不均匀,所以选择试管口向下的A装置制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向下排空气法收集,所以选择C装置,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗空间大,水柱不易极速上升,能防止倒吸,故选G装置,故答案为:ACG;
CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,因防止药品中的湿存水以及反应产生的水使反应试管受热不均匀,所以选择试管口向下的A装置制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向下排空气法收集,所以选择C装置,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗空间大,水柱不易极速上升,能防止倒吸,故选G装置,故答案为:ACG;
(2)①A容器压强为150KPa,B容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,故答案为:出现白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O![]() NH3H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红;
NH3H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红;
(3)①盐类水解,水解离子浓度越大,水解程度越小,盐类水解为吸热反应,温度越高,水解程度越大,根据题干提供的限选试剂与仪器中的温度计、恒温水浴槽(可调控温度),可选择温度不同对盐类水解的影响,故答案为:温度;
②根据①可知,该实验为探究温度对氯化铵水解的影响,氯化铵为强酸弱碱盐,水解溶液呈酸性,所以可根据不同温度下,水解的溶液的pH进行判断,所配制溶液的体积都为100mL,m(NH4Cl)相同都为m g,温度不同,分别为T1℃、T2℃,分别测水解后pH,故答案为:
物理量 实验序号 | V(溶液)/mL | NH4Cl质量(g) | 温度(℃) | pH |
1 | 100 | m1 | T1 | Y |
2 | 100 | m2 | T2 | Z |
③读取的待测物理量的数值为Y,Y为pH值,pH=-lgc(H+),c(H+)=10-Ymol/L,NH4++H2O![]() NH3H2O+H+,水解的氯化铵的物质的量为n(NH4Cl)=c(H+)×V=10-Y×0.1mol,则NH4Cl水解反应的平衡转化率为
NH3H2O+H+,水解的氯化铵的物质的量为n(NH4Cl)=c(H+)×V=10-Y×0.1mol,则NH4Cl水解反应的平衡转化率为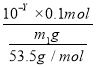 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%。
×100%。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案