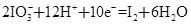题目内容
Ⅰ.用MnO2氧化密度为1.19 g·cm-3,溶质质量分数为36.5%的HCl溶液。反应的化学方程式为: 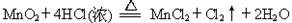
(1)该盐酸的物质的量浓度为 mol/L。
(2)用双线桥法表示出该反应的电子转移方向和数目 。
(3)8.7gMnO2能使 molHCl被氧化。
Ⅱ.在一定体积的18 mol/L的浓硫酸中加入过量铜片,加热使之反应,若被还原
的硫酸为 0.9 mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为________________________________________________。
Ⅰ(1)11.9
(2)
(3)0.2
Ⅱ 大于 3Cu+8H++2NO3-=3Cu2++2NO +4H2O
解析试题分析:Ⅰ.(1)有公式c="1000pw/M=1000×1.19×36.5%/36.5=11.9" mol/L;
(2)
(3)在反应中MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1mol MnO2氧化2mol浓盐酸,所以8.7gMnO2能使0.2molHCl被氧化.
Ⅱ.已知反应 Cu+2H2SO4 CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9="1.8(mol)"
CuSO4+2H2O+SO2 ↑硫酸有一半被还原所以硫酸总物质的量为2×0.9="1.8(mol)"
又知,硫酸的物质的量浓度为18mol/L ;所以原体积为1.8/18=0.1L;参加反应H2SO4为0.9mol×2=1.8mol,体积100mL,因反应后稀H2SO4不与Cu反应,故H2SO4体积应大于100mL。加入硝酸盐后,相当于铜与稀硝酸反应,3Cu+8H++2NO3-=3Cu2++2NO +4H2O
考点:实验室制取氯气的反应,及铜与浓硫酸的反应

某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):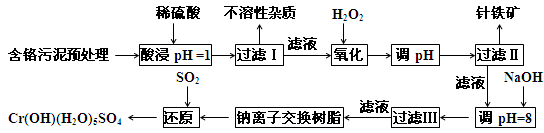
常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将_____________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是_____________________________________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为________________________。
(4)试配平最后一步相关的氧化还原方程式:
_____Na2Cr2O7 + ______SO2 + _______ H2O =" ______" Cr(OH)(H2O)5SO4 + ______ Na2SO4,每生成1mol Cr(OH)(H2O)5SO4时,该反应中转移的电子数为__________。
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)利用反应:6NO2+8NH3 7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
7N2+12H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下的体积是 L。
(2)①已知:2SO2(g)+O2(g) 2SO3(g) ΔH=?196.6 kJ·mol–1
2SO3(g) ΔH=?196.6 kJ·mol–1
2NO(g)+O2(g) 2NO2(g) ΔH=?113.0 kJ·mol–1
2NO2(g) ΔH=?113.0 kJ·mol–1
请写出NO2与SO2反应生成SO3(g)和NO的热化学方程式 。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则该反应的平衡常数K= 。
(3)汽车尾气中的一氧化碳可通过如下反应降低其浓度:CO(g)+1/2O2(g) CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
CO2(g)。已知某温度下,在两个恒容密闭容器中进行该反应,容器中各物质的起始浓度及正、逆反应速率关系如下表所示。请用“>”或“<”或“=”填写表中的空格。
| 容器编号 | c(CO)/mol·L–1 | c(O2)/mol·L–1 | c(CO2)/mol·L–1 | υ(正)和υ(逆) 大小比较 |
| ① | 2.0×10–4 | 4.0×10–4 | 4.0×10–4 | υ(正)=υ(逆) |
| ② | 1.0×10–3 | 4.0×10–4 | 5.0×10–4 | υ(正) υ(逆) |
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|
 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
| | 0 min | l min | 2 min | 3 min | 4 min |
| N2 | 1.500 | 1.400 | 1.200 | c1 | c1 |
| H2 | 4.500 | 4.200 | 3.600 | c2 | c2 |
| NH3 | 0 | 0.200 | 0.600 | c3 | c3 |
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。
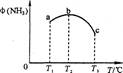
A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g): △H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
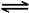 CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)
CO2(g)+H2(g) △H=-41kJ/mol,某温度下,向容积为2L的密闭容器中充入2.0molCO(g)和2.0molH2O(g),在tmin时达到平衡,测得放出了32.8kJ热量,则tmin内用H2表示的平均反应速率为 ,由此可知在该温度下反应CO2(g)+H2(g)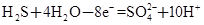 ②
②