题目内容
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Fe3+、Al3+、Cu2+、Mg2+):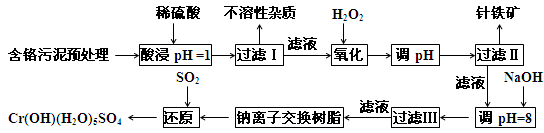
常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.3 | 3.7 | 4.7 | --- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 6.7 | 9(>9 溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是____________________(至少写一条)。
(2)加入H2O2 目的是氧化_______离子,其有关的离子方程式______________________。针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(3)调pH=8是为了将_____________离子(从Fe3+、Al3+、Cu2+、Mg2+中选择)以氢氧化物沉淀的形式除去。滤出的沉淀中部分沉淀将溶解于足量的氢氧化钠溶液中,其有关的离子方程式是_____________________________________,取少量上层澄清溶液,向其中通入足量的CO2,又能重新得到相应的沉淀, 其有关的离子方程式为________________________。
(4)试配平最后一步相关的氧化还原方程式:
_____Na2Cr2O7 + ______SO2 + _______ H2O =" ______" Cr(OH)(H2O)5SO4 + ______ Na2SO4,每生成1mol Cr(OH)(H2O)5SO4时,该反应中转移的电子数为__________。
(1)升高温度、搅拌、延长浸取时间、过滤后再次浸取(其他合理答案也可)(1分);
(2)Fe2+(1分), 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O(2分), FeO(OH) (1分);
(3)Al3+、Cu2+(1分), Al(OH)3 + OH- = AlO2- + 2H2O(2分),
AlO2- + 2H2O + CO2 = Al(OH)3↓+ HCO3- (2分)
(4)1 ,3 ,11, 2 ,1(2分), 3NA(2分)(或1.806´1024);
解析试题分析:流程的初期为酸浸,使工业污泥中的物质充分溶解,为提高效率可采取“升高温度、搅拌、延长浸取时间、过滤后再次浸取”的措施;结合题给的图表,确定过氧化氢的作用是氧化Fe2+,其反应的离子方程式为 2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O;由针铁矿的化学式量89,可确定其化学式为FeO(OH);调节p H=8时Al3+、Cu2+全部沉淀,加入NaOH,可发生反应Al(OH)3 + OH- = AlO2- + 2H2O;通入CO2时发生反应AlO2- + 2H2O + CO2 = Al(OH)3↓+ HCO3- ;由得失电子守恒配平氧化还原反应方程式,并计算转移的电子数。
考点:本题以工艺流程为情景,结合元素化合物的性质,考查了氧化还原反应及其方程式的配平和计算。

短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
| | X | Y | Z |
| W | | | |
(1)X元素在元素周期表中的位置___ __________。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阴离子的电子式为_______________。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为 _。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器____(填“能”或“不能”)用来腌制咸菜,原因是_________________________________________。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________。

关于该电池的下列说法,正确的是______
A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
 。
。 为探索工业含铝、铁、铜合金废料的再利用,甲同学设计的实验方案如下: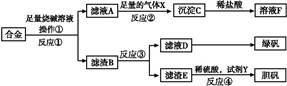
请回答:
(1)操作①用到的玻璃仪器有 。
(2)写出反应①的化学方程式: ,反应②的离子反应方程式: 。
(3)设计实验方案,检测滤液D中含有的金属离子(试剂自选) 。
(4)在滤渣E中加入稀硫酸和试剂Y制胆矾晶体是一种绿色化学工艺,试剂Y为无色液体,反应④的总化学方程式是 。
(5)乙同学在甲同学方案的基础上提出用滤渣B来制备FeCl3·6H2O晶体,在滤渣中滴加盐酸时,发现反应速率比同浓度盐酸与纯铁粉反应要快,其原因是 。
将所得氯化铁溶液用加热浓缩、降温结晶法制得FeCl3·6H2O 晶体,而不用直接蒸发结晶的方法来制得晶体的理由是 。
(6)将滤渣B的均匀混合物平均分成四等份,分别加入同浓度的稀硝酸,充分反应后,在标准状况下生成NO的体积与剩余金属的质量见下表(设硝酸的还原产物只有NO)。
| 实验编号 | ① | ② | ③ | ④ |
| 稀硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
则硝酸的浓度为 ;③中溶解铜的质量为 ;④中V= 。


 )与季戊四醇(
)与季戊四醇(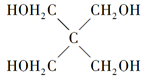 )以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示:
)以物质的量之比2:1反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体。季戊四醇与X的核磁共振氢蛮如下图所示: