题目内容
【题目】根据题意解答
(1)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气.
已知:①N2(g)+2O2(g)=N2O4 (g)△H1=﹣195kJmol﹣1
②N2H4 (1)+O2(g)=N2(g)+2H2O(g)△H2=﹣534.2kJmol﹣1
写出肼和N2O4 反应的热化学方程式;
(2)肼一空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景.其工作原理如图所示,回答下列问题: 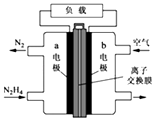
①该燃料电池的负极发生的反应式为 .
②电池工作时,OH﹣移向极(“a”或“b”)
③当电池放电转移5mol电子时,至少消耗燃料肼g.
(3)LiCoO2可用作一种锂离子电池的正极材料.该锂离子电池充电过程中,负极发生的反应为6C+xLi++xe﹣═LixC6 , 正极发生LiCoO2与Li1﹣xCoO2之间的转化,写出放电时电池总反应方程式 .
【答案】
(1)2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣1048.9kJ/mol
(2)N2H4+4OH﹣﹣4e﹣=N2+4H2O;a;40
(3)Li1﹣xCoO2+LixC6═6C+LiCoO2
【解析】解:(1)肼可作为火箭发动机的燃料,与氧化剂N2H4反应生成N2和水蒸气,将方程式②×2﹣①得肼和N2H4 反应的热化学方程式2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣1048.9kJ/mol,所以答案是:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=﹣1048.9kJ/mol;(2)①燃料电池的正极是氧气在正极发生还原反应,负极发生氧化反应,是肼在反应,肼中的N从﹣2价升高到0价,碱性电池中,其电极反应式应为:N2H4+4OH﹣﹣4e﹣=N2+4H2O,
所以答案是:N2H4+4OH﹣﹣4e﹣=N2+4H2O;②原电池中阴离子移向负极,a为负极,所以电池工作时,OH﹣移向a电极,所以答案是:a;③负极电极反应式为N2H4+4OH﹣﹣4e﹣=4H2O+N2↑,转移4mol电子时消耗肼32g,则转移5mol电子消耗肼32g× ![]() =40g,所以答案是:40;(3)放电时,负极反应为:LixC6﹣xe﹣═6C+xLi+ , 正极Li1﹣xCoO2+xLi++xe﹣=LiCoO2 , 总电池反应方程式为:Li1﹣xCoO2+LixC6═6C+LiCoO2 ,
=40g,所以答案是:40;(3)放电时,负极反应为:LixC6﹣xe﹣═6C+xLi+ , 正极Li1﹣xCoO2+xLi++xe﹣=LiCoO2 , 总电池反应方程式为:Li1﹣xCoO2+LixC6═6C+LiCoO2 ,
所以答案是:Li1﹣xCoO2+LixC6═6C+LiCoO2 .

【题目】根据实验内容填空:
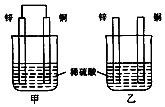
(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验. 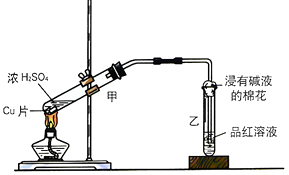
①写出甲装置中发生的主要反应的化学方程式 .
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是 , 原因是 . 
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
① | 有气泡产生 | 化学方程式为: |
② | 紫色石蕊试液变色 | 证明SO2溶于水显酸性 |
③ | 品红溶液褪色 | 证明SO2具有性 |
④ | 溶液变浑浊 | 证明SO2具有性 |
⑤ | 溴水褪色 | 证明SO2具有性 |
⑥ | 吸收尾气 | 证明SO2属于性氧化物 |