题目内容
【题目】下列各组离子能在溶液中大量共存的是( )
A.Na+、Mg2+、Cl、OH
B.H+、Ca2+、 ![]() 、
、 ![]()
C.Cu2+、K+、 ![]() 、
、 ![]()
D.Na+、 ![]() 、OH、Ca2+
、OH、Ca2+
【答案】C
【解析】溶液中的离子能否大量共存,关键是看离子间能否发生反应。Mg2+和OH能反应生成Mg(OH)2沉淀,即Mg2++2OH=Mg(OH)2↓;H+和 ![]() 、Ca2+和
、Ca2+和 ![]() 都发生反应,即2H++
都发生反应,即2H++ ![]() =H2O+CO2↑,Ca2++
=H2O+CO2↑,Ca2++ ![]() =CaCO3↓;
=CaCO3↓; ![]() 和OH生成
和OH生成 ![]() 、Ca2+和生成的
、Ca2+和生成的 ![]() 又生成CaCO3沉淀,即
又生成CaCO3沉淀,即 ![]() +OH=H2O+
+OH=H2O+ ![]() ,Ca2++
,Ca2++ ![]() =CaCO3↓;唯有选项C中的离子间不会发生反应。
=CaCO3↓;唯有选项C中的离子间不会发生反应。
故答案为:C
根据离子间能否发生离子反应进行判断离子能否大量共存即可.

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】根据实验内容填空:
(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验. 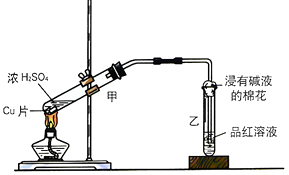
①写出甲装置中发生的主要反应的化学方程式 .
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是 , 原因是 . 
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
① | 有气泡产生 | 化学方程式为: |
② | 紫色石蕊试液变色 | 证明SO2溶于水显酸性 |
③ | 品红溶液褪色 | 证明SO2具有性 |
④ | 溶液变浑浊 | 证明SO2具有性 |
⑤ | 溴水褪色 | 证明SO2具有性 |
⑥ | 吸收尾气 | 证明SO2属于性氧化物 |
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 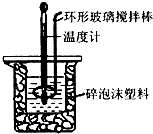
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪器除胶头滴管外还要;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为J[中和后生成的溶液的比热容c=4.2J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)若用50mL 0.55molL﹣1的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会(填“偏大”、“偏大”或“不变”),其原因是 .