题目内容
【题目】二草酸合铜(II)酸钾晶体{K2[Cu(C2O4)2]·2H2O}(其相对式量为354),是一种工业用化工原料。微溶于冷水,可溶于热水,微溶于酒精,干燥时较为稳定,加热时易分解。现以胆矾和草酸为原料制备二草酸合铜( II)酸钾晶体流程如下:
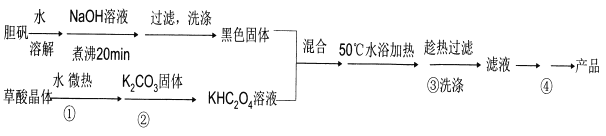
(已知:H2C2O4![]() CO↑十CO2↑+H2O)
CO↑十CO2↑+H2O)
请回答:
(1)第①步操作要微热溶解,其原因是加快溶解速率和________。
(2)为了将滤纸上的黑色固体充分转移到热的KHC2O4溶液中,以下操作方案中最合理的是______。
A.用水溶解滤纸上的黑色固体,然后将溶液转入热的KHC2O4溶液中
B.用硫酸溶液溶解滤纸上的氧化铜,然后转入热的KHC2O4溶液中
C.黑色固体连同滤纸一起加入到热的KHC204溶液中,待充分反应后趁热过滤
D.先将黑色固体转入溶液中,再在空气中灼烧滤纸,将剩余的固体转入热的KHC2O4溶液中
(3)50℃水浴加热至反应充分,写出该反应的化学方程式___________。
(4)步骤③所用的洗涤剂最合适的是_______。
(5)二草酸合铜(II)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;b.________ 。
②在蒸发浓缩的初始阶段可通过_______(填操作名称)回收乙醇。
(6)准确称取制取的晶体试样l.000g溶于NH3·H2O中,并加水定容至250mL,取试样溶液25.00mL于锥形瓶中,再加入l0mL 3.000mol/L的H2SO4溶液,用0.01000mol/L的KMnO4溶液滴定,消耗KMnO4标准液20.00mL,则该产品的纯度是_______ 。
【答案】 可避免H2C2O4分解 C CuO+2KHC2O4![]() K2[Cu(C2O4)2]+H2O 热水 降低硫酸铜的溶解度,有利于硫酸铜晶体析出 蒸馏 88.50%
K2[Cu(C2O4)2]+H2O 热水 降低硫酸铜的溶解度,有利于硫酸铜晶体析出 蒸馏 88.50%
【解析】本题考查化学工艺流程,(1)草酸受热易分解,第①步操作微热溶解原因是加快溶解速率和防止H2C2O4分解;(2)A、黑色固体为CuO,CuO不溶于水,故A错误;B、引入SO42-新的杂质,故B错误;C、此操作方案可行,故C正确;D、灼烧滤纸,然后转入热的KHC2O4溶液,容易引入新的杂质,故D错误;(3)CuO和KHC2O4反应生成二草酸合铜(II)酸钾晶体,因此化学反应方程式为CuO+2KHC2O4![]() K2[Cu(C2O4)2]+H2O;(4)根据题中所给信息,二草酸合铜(II)酸钾微溶于冷水,可溶于热水,微溶于酒精,根据流程,③得到的是滤液,因此所用的洗涤剂为热水;(5)①b.硫酸铜不溶于乙醇,因此使用乙醇可以降低硫酸铜的溶解度,有利于硫酸铜晶体的析出;②乙醇易挥发,因此可通过蒸馏的方法回收乙醇;(6)根据得失电子数目守恒,因此有n(MnO4-)×5=n(C2O42-)×2×(4-3),解得n(C2O42-)=20.00×10-3×0.01000×5/2mol=5×10-4mol,即二草酸合铜(II)酸钾物质的量为5×10-4/2mol=2.5×10-4mol,产品的纯度为
K2[Cu(C2O4)2]+H2O;(4)根据题中所给信息,二草酸合铜(II)酸钾微溶于冷水,可溶于热水,微溶于酒精,根据流程,③得到的是滤液,因此所用的洗涤剂为热水;(5)①b.硫酸铜不溶于乙醇,因此使用乙醇可以降低硫酸铜的溶解度,有利于硫酸铜晶体的析出;②乙醇易挥发,因此可通过蒸馏的方法回收乙醇;(6)根据得失电子数目守恒,因此有n(MnO4-)×5=n(C2O42-)×2×(4-3),解得n(C2O42-)=20.00×10-3×0.01000×5/2mol=5×10-4mol,即二草酸合铜(II)酸钾物质的量为5×10-4/2mol=2.5×10-4mol,产品的纯度为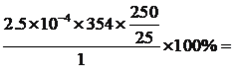 88.50%。
88.50%。

 阅读快车系列答案
阅读快车系列答案
