题目内容
【题目】(1)图1表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边溶液中同时各滴入几滴酚酞溶液,请回答以下问题:
①X极上的电极反应式是______________________________________________________。
②电解NaCl溶液的离子方程式是____________________________________________。
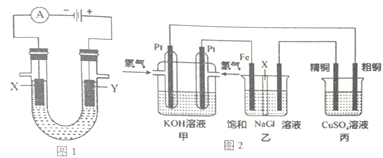
(2)图2是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
①通入氢气电极的反应式为______________________________________________________________。
②石墨电极(乙装置中右侧电极)为__________极(填“阳”或“阴”),反应一段时间后,在乙装置中滴入酚酞溶液,__________极区(填“铁”或“石墨”)的溶液变红。
③如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”、“减小”或“不变”)。
④若在标准状况下,有224mL氧气参加反应,则乙装置中铁电极上生成的气体在标况下体积为__________L;丙装置中阴极析出铜的质量为__________g。
【答案】 2H++2e-= H2↑ 2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH- H2-2e-+ 2OH-═ 2H2O 阳 铁 减小 0.448 1.28
Cl2↑+ H2↑+ 2OH- H2-2e-+ 2OH-═ 2H2O 阳 铁 减小 0.448 1.28
【解析】(1)①X极为阴极,溶液中H+得电子发生还原反应,正确答案:2H++2e-= H2↑;
②惰性电极电解饱和食盐水,阴极产生氢气和氢氧化钠溶液,阳极产生氯气;正确答案:2Cl-+2H2O ![]() Cl2↑+ H2↑+ 2OH-;
Cl2↑+ H2↑+ 2OH-;
(2)①通入氢气电极为原电池的负极,在碱性环境下氢气失电子发生氧化反应,正确答案:H2-2e-+ 2OH-═ 2H2O;
②通入氢气的一极为原电池的负极,铁电极为电解池的阴极,所以乙装置中右侧电极为阳极;正确答案:阳;电解饱和食盐水,阴极产生氢气,氢离子浓度减少,氢氧根离子浓度增大,碱性增强,滴入酚酞,铁电极附近溶液变红;正确答案:铁;
③如果粗铜中含有锌、银等杂质,锌的活泼性比铜强,先于铜失电子,发生氧化反应,硫酸铜溶液中铜离子得电子,在阴极被还原出来,导致溶液中硫酸铜溶液浓度将减少;正确答案:减少;
④ 串联电路电子转移数目相等;1mol氧气转移4mol电子,224mL氧气参加反应共转移电子0.04mol,阴极铁附近,极反应:2H++2e-= H2↑, 产生氢气0.02mol,,体积为 0.448L;正确答案:0.448;丙中阴极极反应为Cu2++2e-=Cu,产生金属铜0.02 mol,质量为1.28 g;正确答案:1.28;

 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】某学生欲用0.100 0 mol·L-1的盐酸来滴定未知浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用0.100 0 mol·L-1的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视____________。直到因加入一滴盐酸后,溶液由红色变为无色,且____________为止。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为____________mL,终点读数为____________mL。

(3)某学生根据三次实验分别记录有关数据如下:
滴定次数 | 氢氧化钠溶液/mL | 0.100 0 mol·L-1 盐酸的体积(mL) | ||
滴定前 | 滴定后 | 消耗 | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=______________。



