题目内容
2,2,4,4-四甲基戊烷与氯气发生取代反应,生成的一氯代物的种类可能有
- A.4种
- B.3种
- C.2种
- D.1种
C

练习册系列答案
相关题目
Ⅰ.配平下列反应方程式:
NaIO3+ NaHSO3-- I2+ Na2SO4+ H2SO4+ H2O
Ⅱ.废旧金属的回收再利用是保护自然资源的有力措施.一批成分不详的合金废料,为了确定其成分和再利用途径,探究性学习小组拟定以下方案进行实验分析:
请回答下列问题:
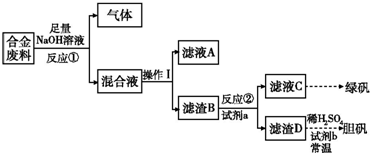
(1)从上述信息知,该合金中可确定的成分有 ;(填化学式)
(2)滤渣D中加入稀硫酸和试剂b,常温下可制得胆矾,是一种绿色化学工艺,则试剂b是 ;写出总反应方程式 ;
(3)甲、乙两同学都验证了反应①生成气体是氢气,甲同学推断滤液A应是NaAlO2;乙同学查阅资料得知硅与NaOH溶液反应也有H2放出,因此持不同意见,请你设计一最佳方案,帮助他们作一确证:(写出选用试剂、实验判断现象及得出结论)
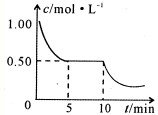
(4)取质量均为m g的滤渣B四份,分别加入同浓度,不同体积的稀HNO3充分反应,在标准状况生成NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
①实验1溶解的金属是 ;质量为 g;
②写出实验4中金属恰好溶解后,发生反应的离子方程式: .实验4中V的数值为 .
Ⅱ.废旧金属的回收再利用是保护自然资源的有力措施.一批成分不详的合金废料,为了确定其成分和再利用途径,探究性学习小组拟定以下方案进行实验分析:
请回答下列问题:

(1)从上述信息知,该合金中可确定的成分有
(2)滤渣D中加入稀硫酸和试剂b,常温下可制得胆矾,是一种绿色化学工艺,则试剂b是
(3)甲、乙两同学都验证了反应①生成气体是氢气,甲同学推断滤液A应是NaAlO2;乙同学查阅资料得知硅与NaOH溶液反应也有H2放出,因此持不同意见,请你设计一最佳方案,帮助他们作一确证:(写出选用试剂、实验判断现象及得出结论)
(4)取质量均为m g的滤渣B四份,分别加入同浓度,不同体积的稀HNO3充分反应,在标准状况生成NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
②写出实验4中金属恰好溶解后,发生反应的离子方程式:
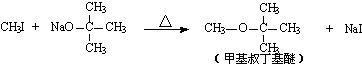
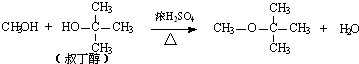
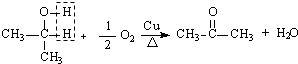 试推测叔丁醇是否能发生类似反应
试推测叔丁醇是否能发生类似反应
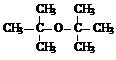
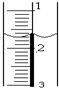 使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).
使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL).