题目内容
Ⅰ.配平下列反应方程式:Ⅱ.废旧金属的回收再利用是保护自然资源的有力措施.一批成分不详的合金废料,为了确定其成分和再利用途径,探究性学习小组拟定以下方案进行实验分析:
请回答下列问题:
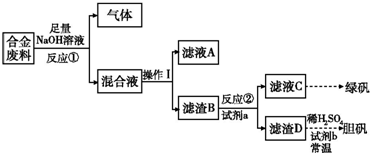
(1)从上述信息知,该合金中可确定的成分有
(2)滤渣D中加入稀硫酸和试剂b,常温下可制得胆矾,是一种绿色化学工艺,则试剂b是
(3)甲、乙两同学都验证了反应①生成气体是氢气,甲同学推断滤液A应是NaAlO2;乙同学查阅资料得知硅与NaOH溶液反应也有H2放出,因此持不同意见,请你设计一最佳方案,帮助他们作一确证:(写出选用试剂、实验判断现象及得出结论)
(4)取质量均为m g的滤渣B四份,分别加入同浓度,不同体积的稀HNO3充分反应,在标准状况生成NO(设还原产物只有一种)体积与剩余固体金属的质量如下表:
| 实验编号 | 1 | 2 | 3 | 4 |
| 稀HNO3体积(mL) | 100 | 200 | 300 | 400 |
| 剩余金属质量(g) | 9.0 | 4.8 | 0 | 0 |
| NO体积(L) | 1.12 | 2.24 | 3.36 | V |
②写出实验4中金属恰好溶解后,发生反应的离子方程式:
分析:(1)氧化还原反应中化合价升高值=化合价降低值=转移电子数,根据电子守恒来配平方程式;
(2)依据流程图中最后的产物分析;
(3)双氧水是一种绿色氧化剂,可以实现金属铜和硫酸之间的反应;
(4)合金中的铝在过量氢氧化钠溶液中溶解生成偏铝酸钠和氢气,利用氢氧化铝溶于强酸溶液,硅酸不溶于酸设计实验验证;硅酸的酸性小于碳酸,二氧化碳过量反应生成碳酸氢钠;
(5)①先判断酸是否完全反应,再根据金属活动性判断反应的金属及生成的金属离子价态,根据1、2两组数据,结合采用极限法分析,确定剩余固体的成分,据此来计算即可;
②在金属消耗完毕以后,硝酸将亚铁离子氧化为三价铁,据此分析.
(2)依据流程图中最后的产物分析;
(3)双氧水是一种绿色氧化剂,可以实现金属铜和硫酸之间的反应;
(4)合金中的铝在过量氢氧化钠溶液中溶解生成偏铝酸钠和氢气,利用氢氧化铝溶于强酸溶液,硅酸不溶于酸设计实验验证;硅酸的酸性小于碳酸,二氧化碳过量反应生成碳酸氢钠;
(5)①先判断酸是否完全反应,再根据金属活动性判断反应的金属及生成的金属离子价态,根据1、2两组数据,结合采用极限法分析,确定剩余固体的成分,据此来计算即可;
②在金属消耗完毕以后,硝酸将亚铁离子氧化为三价铁,据此分析.
解答:解:(1)化学反应中碘元素化合价从+5价降为0价,生成1mol碘单质共降低10价,硫元素的化合价从+4价升高到+6价,2molNaHSO3生成1molNa2SO4共升高了4价,根据电子守恒和原子守恒,则碘酸钠的前面系数是4,亚硫酸氢钠的系数是10,即4NaIO3+10NaHSO3=2I2+7Na2SO4+3H2SO4+2H2O,
故答案为:4;10;2;7;3;2;
(2)依据流程图中最后的产物有绿矾和蓝矾,说明原合金中含有铜和铁,故答案为:Cu、Fe;
(3)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O,
故答案为:H2O2;Cu+H2O2+H2SO4=CuSO4+2H2O;
(4)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是利用氢氧化铝溶液强酸,硅酸不溶于强酸生成沉淀设计验证,方法为:取少量混合液A于试管中,逐滴滴加稀盐酸至过量.先生成白色沉淀,过量,若沉淀完全溶解,则只有Al;若沉淀部分溶解,则Al、Si都有;若沉淀始终不溶,则只有Si;
故答案为:取少量混合液A于试管中,逐滴滴加稀盐酸至过量,先生成白色沉淀,过量,若沉淀完全溶解,则只有Al;若沉淀部分溶解,则Al、Si都有;若沉淀始终不溶,则只有Si;
(5)①由1、2两组数据分析,两次剩余物的质量相差4.2g,此时生成1.12LNO气体(转移0.15 mol电子),若只溶解铁,质量为4.2g,若只溶解铜,质量为4.8g;由此可知实验1中是Fe溶解,其溶解的质量为4.2g,故答案为:Fe;4.2;
②实验1中是Fe溶解,发生反应的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;在金属消耗完毕以后,硝酸将亚铁离子氧化为三价铁,在亚铁离子转化为铁离子过程中,结合试验①可知还会产生1.12L的气体,所以试验④中V=4.48L,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;4.48.
故答案为:4;10;2;7;3;2;
(2)依据流程图中最后的产物有绿矾和蓝矾,说明原合金中含有铜和铁,故答案为:Cu、Fe;
(3)双氧水是一种绿色氧化剂,在双氧水的作用下,金属铜可以和硫酸发生反应:Cu+H2O2+H2SO4=CuSO4+2H2O,
故答案为:H2O2;Cu+H2O2+H2SO4=CuSO4+2H2O;
(4)若反应①产生的气体是H2,则验证滤液A只含NaAlO2、不含Na2SiO3的方法是利用氢氧化铝溶液强酸,硅酸不溶于强酸生成沉淀设计验证,方法为:取少量混合液A于试管中,逐滴滴加稀盐酸至过量.先生成白色沉淀,过量,若沉淀完全溶解,则只有Al;若沉淀部分溶解,则Al、Si都有;若沉淀始终不溶,则只有Si;
故答案为:取少量混合液A于试管中,逐滴滴加稀盐酸至过量,先生成白色沉淀,过量,若沉淀完全溶解,则只有Al;若沉淀部分溶解,则Al、Si都有;若沉淀始终不溶,则只有Si;
(5)①由1、2两组数据分析,两次剩余物的质量相差4.2g,此时生成1.12LNO气体(转移0.15 mol电子),若只溶解铁,质量为4.2g,若只溶解铜,质量为4.8g;由此可知实验1中是Fe溶解,其溶解的质量为4.2g,故答案为:Fe;4.2;
②实验1中是Fe溶解,发生反应的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;在金属消耗完毕以后,硝酸将亚铁离子氧化为三价铁,在亚铁离子转化为铁离子过程中,结合试验①可知还会产生1.12L的气体,所以试验④中V=4.48L,
故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;4.48.
点评:本题考查了物质定量测定的实验方法应用,物质性质的应用和判断是解题关键,数据分析和计算是难点,主要考查了铁、铝、铜及其化合物性质的综合应用和分离方法,题目难度较大.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
 SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol
e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol
e-。