题目内容
10.下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓H2SO4混合共热的方法制取乙酸乙酯,反应的方程式为CH3COOH+CH3CH2OH
 CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂
CH3COOC2H5+H2O.其中浓H2SO4的作用是催化剂和吸水剂[装置设计]甲、乙、丙三位同学分别设计如图三套实验装置:
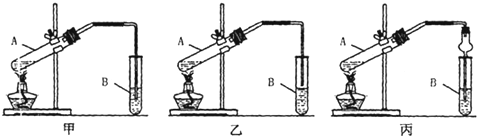
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是乙(选填“甲”或“乙”),丙同学将甲装置中的玻璃管改成球形干燥管,除起冷凝作用外,另一重要作用是防止倒吸
[实验步骤]
①按我选择的装置仪器,在试管中先加入3mL乙醇,并在摇动下缓缓加入2mL浓H2SO4 充分摇匀,冷却后再加入2mL冰醋酸;②将试管固定在铁架台上;③在试管B中加入适量的饱和Na2CO3溶液;④用酒精灯对试管A加热;⑤当观察到试管B中有明显现象时停止实验.
[问题讨论]
(1)步骤①装好实验装置,加入样品前还应检查检查装置气密性.
(2)从试管B中分离出乙酸乙酯的实验操作是分液.
分析 [实验原理]酯化反应的本质为酸脱羟基,醇脱氢,乙醇、乙酸反应生成乙酸乙酯和水,且为可逆反应;乙酸与乙醇需浓硫酸作催化剂,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动;
[装置设计]根据粗产品乙酸乙酯、乙酸和乙醇的混合物中各自的性质,以及加热不充分也能产生倒吸进行解答;
[实验步骤](1)实验前,要检查装置的气密性;(2)分离互不相溶的液体通常用分液的方法.
解答 解:[实验原理]酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应方程式为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O,乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,
CH3COOC2H5+H2O,乙酸与乙醇发生酯化反应,该反应为可逆反应,需浓硫酸作催化剂,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动,故浓硫酸的作用为催化剂、吸水剂,
故答案为:CH3COOH+CH3CH2OH CH3COOC2H5+H2O;催化剂、吸水剂(顺序可以颠倒);
CH3COOC2H5+H2O;催化剂、吸水剂(顺序可以颠倒);
[装置设计]乙酸乙酯中混有乙醇和乙酸,二者易溶于水而产生倒吸,加热不充分也能产生倒吸,可用乙装置制取,防止倒吸回流现象的发生;丙同学将甲装置中的玻璃管改成了球形干燥管,除起冷凝作用外,球形干燥管球形部分由于容积较大,也能起到防止倒吸的作用,
故答案为:乙;防止倒吸;
[问题讨论](1)实验前,要检查装置的气密性,否则会导致实验失败,
故答案为:检查装置气密性;
(2)因B中的液体混合物分层不互溶,乙酸乙酯在上层,可用分液方法分离,
故答案为:分液.
点评 本题考查制备实验方案的设计,为高频考点,把握制取乙酸乙酯的反应原理及实验室的制备方法,明确浓硫酸、饱和碳酸钠溶液的作用,特别注意吸收乙酸乙酯的导管不能伸入液面以下,否则会发生倒吸现象等为解答的关键,侧重分析与实验能力的考查,题目难度不大.

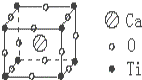 已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )
已知某化合物是由钙、钛、氧三种元素组成的晶体,其晶胞结构如图所示,则该物质的化学式为( )| A. | CaTiO3 | B. | CaTiO6 | C. | Ca4TiO3 | D. | CaTiO12 |
| A. | 离子键就是阴阳离子间强烈的静电作用 | |
| B. | H和Cl形成的分子中存在的是极性共价键 | |
| C. | 氯化铵中没有金属元素,所以不是离子化合物 | |
| D. | 11号与9号元素能够形成离子化合物,该化合物中存在离子键 |
| A. | 原子半径:W>Z>Y>X>M | |
| B. | XZ2、X2M4均为直线形的共价化合物 | |
| C. | W2Z2是既含离子键又含共价键的离子化合物 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键 |
| A. | 只含有C、H两种元素 | |
| B. | 只含有C、O两种元素 | |
| C. | 含有C、H、O三种元素 | |
| D. | 一定含有C、H两种元素,不能确定是否含有O元素 |
| A. | 8 | B. | 10 | C. | 16 | D. | 24 |
| A. | pH=3的盐酸和pH=5的硫酸等体积混合,pH=4 | |
| B. | 室温下,pH=9的碱性溶液中,可能存在CH3COOH分子 | |
| C. | 中性溶液中必然有c(H+)=c(OH-)=1×10-7 mol/L | |
| D. | 在0.1 mol/L HCl溶液中加入适量的蒸馏水,溶液中各种离子的物质的量浓度均减小 |

 ;写出E与G反应生成H的结构简式是
;写出E与G反应生成H的结构简式是 .
.