题目内容
【题目】下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是

A. a先通入CO2,然后b通入NH3,c中放碱石灰
B. a先通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
C. b先通入NH3,然后a通入CO2,c中放碱石灰
D. b先通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
【答案】B
【解析】
候氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3;在这一实验过程中,由于C02在水中的溶解度较小,而NH3的溶解度较大,为防止倒吸,b管通C02,a管通NH3,所以要向食盐水中先通NH3再通C02,否则C02通入后会从水中逸出,再通NH3时溶液中C02的量很少,得到的产品很少;在这个实验中的尾气主要是C02和NH3,其中NH3对环境影响较大,要进行尾气处理,而NH3是碱性气体,所以在c装置中要装酸性物质,据此进行推断。
“侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3,为防止倒吸,a管通NH3,b管通C02;由于C02在水中的溶解度较小,而NH3的溶解度较大,所以要在食盐水先通NH3然后再通C02,否则C02通入后会从水中逸出,等再通NH3时溶液中C02的量就很少了,这样得到的产品也很少,氨气是碱性气体,可以用蘸稀硫酸的脱脂棉吸收氨气,防止污染空气,答案选B。

【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。己知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
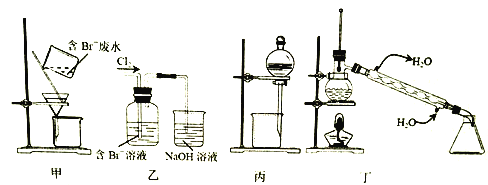
下列说法正确的是
A. 用甲装置过滤时,需不断搅拌
B. 丙装置中用正十二烷而不用CCl4,是因为其密度小
C. 用乙装置将Br-氧化为Br2
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2