题目内容
【题目】实验室有一包暗红色粉末样品可能是MgCO3、Fe2O3和FeO的混合物。经测定后,结论是不存在FeO。
I.某学生想自己设计实验方案,以证明样品中确实没有FeO。除样品外,实验室只提供以下试剂:KMnO4溶液、稀盐酸、稀硫酸、KSCN溶液、NaOH溶液,请你描述实验操作的步骤、实验现象和结论:__________________________________________________。
Ⅱ.测定混合物中Fe2O3的含量
实验室可用多种方法测定上述样品中Fe2O3的质量分数,某同学准备用如图所示各仪器 按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数。
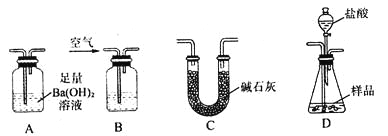
请回答下列问题:
(1)盛装盐酸的仪器的名称是___________,装置的连接顺序是___________→____________→____________→____________(填图中序号字母,各仪器只能选用一次)。
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是________________________________________________。
(3)为提高测定的准确度,在B中最应加入的物质是下列各项中的_____________(填序号)。
a.饱和NaHCO3溶液 b.蒸馏水
c.浓硫酸 d.NaOH溶液
(4)在进行实验方案评价时,有同学认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求。实验证明,若用此法测得Fe2O3的质量分数将__________(填“偏大”“偏小”或“不变”之一)。
【答案】取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO。 分液漏斗 B→D→A→C 将D中生成的CO2全部赶入A装置中 d 偏小
【解析】
I.亚铁离子具有还原性,能使酸性高锰酸钾溶液褪色,所以要证明样品中确实没有FeO其实验操作为I取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO。。
Ⅱ.(1)盛装盐酸的仪器的名称是分液漏斗。要测定氧化铁的质量分数需要利用碳酸镁与盐酸反应生成CO2,通过测量CO2来计算碳酸镁,进而计算氧化铁的质量分数。为保证产生的CO2全部进入氢氧化钡溶液中,需要利用空气,又因为空气中也含有水蒸气和CO2,所以装置的连接顺序是 B→D→A→C。
(2)根据以上分析可知实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是将D中生成的CO2全部赶入A装置中。
(3)空气中含有CO2,所以为提高测定的准确度,需要把空气中的CO2除去。因此在B中最应加入的物质是NaOH溶液。
(4)由于反应中产生的CO2含有水蒸气,也能被氢氧化钡溶液吸收,导致测定的碳酸镁质量偏高,因此若用此法测得Fe2O3的质量分数将偏小。

 阅读快车系列答案
阅读快车系列答案【题目】教材中给出了Na2O2与水反应的化学方程式,某学习小组通过实验研究Na2O2与水发反应机理
操作 | 现象 |
Ⅰ | 剧烈反应,产生的气体能使带火星木条复燃,固体全部溶解后,得到的无色溶液a |
Ⅱ | 溶液变红,10分钟后溶液颜色明显变浅,稍后,溶液变为无色 |
Ⅲ | 又有大量气泡产生,产生的气体也能使带火星木条复燃 |
(1)Na2O2的电子式为 ______ ,很明显,实验证实了溶液a中H2O2的存在,应用同位素示踪原理可以表示反应的机理,写出Na218O2与H2O反应的化学方程式 ______ .
(2)操作Ⅱ中红色褪去的可能原因是 ______ .
(3)用反应![]() 测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______
测定溶液a中H2O2含量.取20.00ml溶液a,用稀 ______ ![]() 填化学式
填化学式![]() 酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______
酸化,用0.002molL-1KMnO4溶液滴定,至终点时平均消耗10.00ml KMnO4溶液.滴定时KMnO4溶液应装在 ______ ![]() 填酸或碱
填酸或碱![]() 式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
式滴定管中,终点确定的方法是 ______ ,经计算溶液a中c(H2O2)= ______ molL-1
(4)向溶液a中滴加FeSO4溶液,发生反应的离子方程式为______ .
(5)向FeSO4溶液中加入一定量Na2O2固体,并以物质的量为2:1发生反应,反应中无气体生成,写出反应的离子方程式 ______ .