题目内容
【题目】NOx是造成大气污染的主要物质,用还原法将其转化为无污染的物质,对于消除环境污染有重要意义。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1=-221.0kJ/mol
2CO(g) △H1=-221.0kJ/mol
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5kJ/mol
2NO (g) △H2= +180.5kJ/mol
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3=-746.0 kJ/mol
2CO2(g)+N2(g) △H3=-746.0 kJ/mol
则用焦炭还原NO生成无污染气体的热化学方程式为___。该反应的平衡常数Kp=__(写表达式)。
(2)用NH3催化还原NOx也可以消除氮氧化物的污染。已知:8NH3(g)+6NO2(g)![]() 7N2(g) +12H2O(l) △H<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
7N2(g) +12H2O(l) △H<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间变化如图所示。
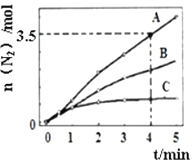
①在催化剂A的作用下,0~4min的v(NH3)=___。
②该反应活化能Ea(A)、Ea(B)、Ea(C)由大到小的顺序是___,理由是__。
③下列说法正确的是__(填标号)。
a.使用催化剂A达平衡时,△H值更大
b.升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
【答案】2NO(g)+ C (s)![]() CO2(g)+N2(g) △H=-573.75kJ/mol
CO2(g)+N2(g) △H=-573.75kJ/mol ![]() 0.5mol/(L
0.5mol/(L![]() min) Ea(C)Ea(B)Ea(A) 相同时间内生成的N2越多,反应速率越快,活化能越低 bcd
min) Ea(C)Ea(B)Ea(A) 相同时间内生成的N2越多,反应速率越快,活化能越低 bcd
【解析】
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1=-221.0kJ/mol ①
2CO(g) △H1=-221.0kJ/mol ①
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5kJ/mol ②
2NO (g) △H2= +180.5kJ/mol ②
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3=-746.0 kJ/mol ③
2CO2(g)+N2(g) △H3=-746.0 kJ/mol ③
将①-②+③,便可得到焦炭还原NO生成无污染气体的热化学方程式;利用方程式可表示出该反应的平衡常数Kp。
(2)①在催化剂A的作用下,0~4min时,n(N2)=3.5mol,n(NH3)=![]() ,利用公式可求出v(NH3);
,利用公式可求出v(NH3);
②从图中可看出,相同时间内,N2的生成量A>B>C,则表明反应速率A>B>C,速率越快则反应的活化能越低,从而可求出该反应活化能Ea(A)、Ea(B)、Ea(C)关系。
③a.催化剂A不能改变反应物的转化率,所以达平衡时,△H值不变;
b.升高温度可使该放热反应左移,容器内NO2的物质的量增大,浓度增大,气体颜色加深;
c.从反应方程式看,单位时间内形成24个N-H键,同时断裂24个O-H键,一旦二者的数目相等,则说明反应已经达到平衡;
d.若在恒容绝热的密闭容器中反应,若平衡移动,则温度发生改变,现平衡常数不变,则温度不变,说明反应已经达到平衡。
(1)已知:2C(s)+O2(g)![]() 2CO(g) △H1=-221.0kJ/mol ①
2CO(g) △H1=-221.0kJ/mol ①
N2(g)+O2(g)![]() 2NO (g) △H2= +180.5kJ/mol ②
2NO (g) △H2= +180.5kJ/mol ②
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H3=-746.0 kJ/mol ③
2CO2(g)+N2(g) △H3=-746.0 kJ/mol ③
将①-②+③,便可得到焦炭还原NO生成无污染气体的热化学方程式2NO(g)+ C (s)![]() CO2(g)+N2(g) △H=-573.75kJ/mol;该反应的平衡常数Kp=
CO2(g)+N2(g) △H=-573.75kJ/mol;该反应的平衡常数Kp=![]() 。
。
答案为:2NO(g)+ C (s)![]() CO2(g)+N2(g) △H=-573.75kJ/mol;
CO2(g)+N2(g) △H=-573.75kJ/mol;![]() ;
;
(2)①在催化剂A的作用下,0~4min时,n(N2)=3.5mol,n(NH3)=![]() ,v(NH3)=
,v(NH3)=![]() mol/(L
mol/(L![]() min);答案为:0.5mol/(L
min);答案为:0.5mol/(L![]() min);
min);
②从图中可看出,相同时间内,N2的生成量A>B>C,则表明反应速率A>B>C,速率越快则反应的活化能越低,从而可求出该反应活化能Ea(A)、Ea(B)、Ea(C)关系为Ea(C)Ea(B)Ea(A);原因是相同时间内生成的N2越多,反应速率越快,活化能越低;
答案为:Ea(C)Ea(B)Ea(A);相同时间内生成的N2越多,反应速率越快,活化能越低;
③a.催化剂A不能改变反应物的转化率,所以达平衡时,△H值不变,a错误;
b.升高温度可使该放热反应左移,容器内NO2的物质的量增大,浓度增大,气体颜色加深,b正确;
c.从反应方程式看,单位时间内形成24个N-H键,同时断裂24个O-H键,一旦二者的数目相等,则说明反应已经达到平衡,c正确;
d.在恒容绝热的密闭容器中反应,若平衡移动,则温度发生改变,现平衡常数不变,则温度不变,说明反应已经达到平衡,d正确。
答案为:bcd。

 阅读快车系列答案
阅读快车系列答案【题目】甲醇是重要的化工原料,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇时,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -99kJmol-1
CH3OH(g) △H1= -99kJmol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= 58kJmol-1
CH3OH(g)+H2O(g) △H2= 58kJmol-1
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3=+41kJmol-1
CO(g)+H2O(g) △H3=+41kJmol-1
(1)一定温度下,向体积为2L的密闭容器中加入CO和H2,假设只发生反应①,达平衡后测得各组分浓度如下:
物质 | CO | H2 | CH3OH |
浓度(molL-1) | 0.9 | 1.0 | 0.6 |
①列式并计算平衡常数K=___。
②若将容器体积压缩为1L,不经计算,预测新平衡中c(H2)的取值范围是___。
③若保持体积不变,再充入0.6molCO和0.4molCH3OH,此时v正__v逆(填“>”、“<”或“=”)。
(2)在实际生产中,当合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率α(CO)与温度和压强的关系如图所示。
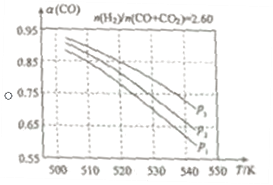
α(CO)值随温度升高而___(填“增大”或“减小”),其原因是___。图中的压强由大到小为___,其判断理由是___。