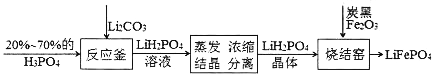
��Ŀ����
����Ŀ���黯�����������������������뵼�弤������̫���ܵ�غ��ټ��ɵ�·��
��1����̬Niԭ�ӵļ۵����Ų�ʽΪ ___����̬Asԭ�ӵ���ռ������ܼ��ĵ���������ͼΪ __ �Ρ�
��2����һ������As ___Se(����>����������) ��ԭ����____��As2O3(��˪)�����������As2O3������������AsCl3��AsCl3��LiAlH4��ԭ����AsH3��
��3����AlH4-������ԭ�ӵ��ӻ���ʽΪ___����ռ乹��Ϊ____��д��һ����AlH4-��Ϊ�ȵ�����ķ��ӵĻ�ѧʽ___��
��AsH3������H��As��H����__109.5�����>������=������)��AsH3�е����NH3����ԭ����____��
��4���л���![]() �����ƻ�˯������ȱ�ٵ�ҩ����л����д��ڵĻ�ѧ��������Ϊ____(����ĸ���)��
�����ƻ�˯������ȱ�ٵ�ҩ����л����д��ڵĻ�ѧ��������Ϊ____(����ĸ���)��
a�����Ӽ� b������ c������ d��̼̼˫��
��5���黯��������ҽѧ����������Ƥ����ճĤ����ĸ�Ⱦ������ȣ��黯��������ͼ��ʾ���þ����ܶ���Ϊ____g��cm-3(��ʽ���ɣ����ػ���)��

���𰸡�3d84s2 ���壨�Ĵ��� �� AsԪ��ԭ�ӵ�4p����ϵĵ��ӳʰ���״̬���Ƚ��ȶ� sp3 �������� SiH4��CH4 �� Һ̬NH3���Ӽ����γ������AsH3���Ӽ�ֻ�з��»��� abc ![]() ��
��![]() ��
��![]()
��������
��1��Niԭ������Ϊ28����̬Niԭ�ӵļ۵���Ϊ3d�ܼ��ϵ�8�����ӡ�4s�ܼ��ϵ�2�����ӣ���̬Asԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s24p3���û�̬ԭ����ռ������ܼ��ĵ���Ϊ4p���ӣ�Ϊ�����Σ�
��2��ԭ�ӹ���е��Ӵ���ȫ����ȫ�ջ���ʱ���ȶ���
��3����AlH4��������ԭ��Al�ļ۲���ӶԸ���=4+(3+1-4��1)/2=4�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ��������ж�Alԭ���ӻ���ʽ����ռ乹�ͣ���AlH4����Ϊ�ȵ�����ķ����к���5��ԭ�ӡ��۵�������8��
��AsH3������Asԭ�Ӽ۲���ӶԸ���=3+(5-3��1)/2=4�Һ���1���µ��Ӷԣ��÷���Ϊ�����νṹ���µ��Ӷ���ɼ����Ӷ�֮����ų������ڳɼ����Ӷ�֮����ų�������������Ǽ�С��
�����Ӽ����γ�������⻯���۷е�ϸߣ�
��4���л���![]() �й��۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ���
�й��۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ���
��5���þ�����Niԭ�Ӹ���=4��1/12+4��1/6+2��1/3+2��1/6=2��Asԭ�Ӹ���Ϊ2��Ni��Asԭ�Ӹ���֮��Ϊ2��2=1��1���������=��a��10-10 cm��2��sin60���b��10-10cm=![]() �������ܶ�=
�������ܶ�=![]() ��������㡣
��������㡣
��1��Niԭ������Ϊ28����̬Niԭ�ӵļ۵���Ϊ3d�ܼ��ϵ�8�����ӡ�4s�ܼ��ϵ�2�����ӣ���̬Asԭ�Ӻ�������Ų�ʽΪ[Ar]3d104s24p3����۵����Ų�ʽΪ3d84s2���û�̬ԭ����ռ������ܼ��ĵ���Ϊ4p���ӣ�Ϊ�����Σ�
��2��ԭ�ӹ���е��Ӵ���ȫ����ȫ�ջ���ʱ���ȶ���AsԪ��ԭ�ӵ�4p����ϵĵ��ӳʰ���״̬���Ƚ��ȶ���
��3����AlH4��������ԭ��Al�ļ۲���ӶԸ���=4+(3+1-4��1)/2=4�������µ��Ӷԣ����ݼ۲���ӶԻ������ۣ�Alԭ���ӻ���ʽΪsp3���ռ乹��Ϊ��������ṹ����AlH4����Ϊ�ȵ�����ķ����к���5��ԭ�ӡ��۵�������8����ȵ������� SiH4��CH4��
��AsH3������Asԭ�Ӽ۲���ӶԸ���=3+(5-3��1)/2=4������1���µ��Ӷԣ��÷��ӹ���Ϊ�����Σ��µ��Ӷ���ɼ����Ӷ�֮����ų������ڳɼ����Ӷ�֮����ų������÷����к��йµ��Ӷԣ���������Ǽ�С��С��109.5�㣻
���Ӽ����γ�������⻯���۷е�ϸߣ�Һ̬NH3���Ӽ����γ������AsH3���Ӽ�ֻ�з��»����������۷е�ϸߣ�
��4���л���![]() ���۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ������Ժ������Ӽ����Ҽ����м���
���۵����д��ڦҼ��������д��ڴ�м��������Ӻ�������֮��������Ӽ������Ժ������Ӽ����Ҽ����м���
��ѡabc��
��5���þ�����Niԭ�Ӹ���=4��1/12+4��1/6+2��1/3+2��1/6=2��Asԭ�Ӹ���Ϊ2��Ni��Asԭ�Ӹ���֮��Ϊ2��2=1��1���������=��a��10-10 cm��2��sin60���b��10-10cm=![]() �������ܶ�=
�������ܶ�=![]() =
= g��cm��3��
g��cm��3��