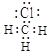题目内容
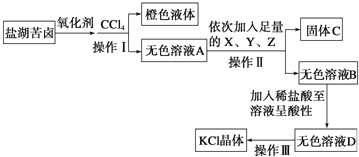
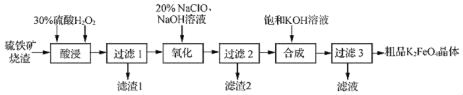
【题目】以硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)生产安全高效的水处理剂高铁酸钾(K2FeO4)的工艺流程如下:
已知:FeO42﹣在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解。
(1)“酸浸”时加入硫酸的量不宜过多的原因是_____。
(2)“氧化”时发生反应的离子方程式为_____。
(3)在控制其他条件不变的情况下,探究保持Fe2(SO4)3和NaOH总质量不变,改变其质量比对K2FeO4产率的影响,实验结果如图所示,当质量比大于0.55时K2FeO4的产率下降的原因可能是_____。

(4)“过滤2”产生的滤渣的主要成分为_____(填化学式),“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、_____、_____(填化学式)。
(5)K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,则反应时K2FeO4与H2S的物质的量之比为_____。
【答案】可以减少“氧化”步骤中NaOH的用量 2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O 当硫酸铁跟氢氧化钠的质量比增大到一定程度时,过多的Fe3+与NaOH反应生成Fe(OH)3,Fe(OH)3可以加速K2FeO4的分解,从而使K2FeO4的产率下降 Mg(OH)2 FeO42﹣ AlO2﹣ 8:3
【解析】
硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)加入稀硫酸、过氧化氢,滤渣1为二氧化硅,滤液中含有铁离子、氯离子和镁离子,加入次氯酸钠溶液和氢氧化钠溶液,混合发生氧化还原反应生成高铁酸钠、氯化钠和水,过滤除去氢氧化镁,滤液中加入氢氧化钾溶液实现高铁酸钠转化为高铁酸钾沉淀,冷却结晶过滤得到高铁酸钾固体,上述工艺得到的高铁酸钾常含有杂质,“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、FeO42﹣、AlO2﹣,可用重结晶法提纯,以此解答该题。
硫铁矿烧渣(主要成分Fe2O3、SiO2,少量的Fe3O4、Al2O3、MgO)加入稀硫酸、过氧化氢,滤渣1为二氧化硅,滤液中含有铁离子、氯离子和镁离子,加入次氯酸钠溶液和氢氧化钠溶液,混合发生氧化还原反应生成高铁酸钠、氯化钠和水,过滤除去氢氧化镁,滤液中加入氢氧化钾溶液实现高铁酸钠转化为高铁酸钾沉淀,冷却结晶过滤得到高铁酸钾固体,上述工艺得到的高铁酸钾常含有杂质,“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、FeO42﹣、AlO2﹣,可用重结晶法提纯,以此解答该题。
(1)为避免后续反应消耗较多的氢氧化钠,则“酸浸”时加入硫酸的量不宜过多;
(2)“氧化”时发生反应的离子方程式为2Fe3++3ClO﹣+10OH﹣═2FeO42﹣+3Cl﹣+5H2O;
(3)题给信息中FeO42﹣在强碱性溶液中稳定,但在Fe(OH)3催化作用下会发生分解,由图象可知,当质量比大于0.55时,过多的Fe3+与NaOH反应生成Fe(OH)3,Fe(OH)3可以加速K2FeO4的分解,从而使K2FeO4的产率下降;
(4)滤渣2含有氢氧化镁,“过滤3”所得滤液中含有的阴离子有OH﹣、Cl﹣、SO42﹣、FeO42﹣、AlO2﹣;
(5)K2FeO4可将水中的H2S氧化为硫酸盐,同时K2FeO4被还原为Fe(OH)3,反应中Fe元素化合价由+6价降低为+3价,S元素化合价由﹣2价升高为+6价,则根据电子得失守恒可知K2FeO4与H2S的物质的量之比为8:3。

 阅读快车系列答案
阅读快车系列答案