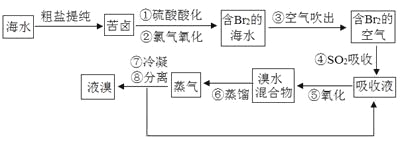
��Ŀ����
����Ŀ�� I����ҵ����ϴ���ķ�ͭм��ԭ�����Ʊ�����ͭ��Ϊ�˽�Լԭ�Ϻͷ�ֹ��Ⱦ�������˲�ȡ�ķ����� ������ţ�
����ͼ����������ͭ��40mLϡ������100mL��ƿ�з�Ӧ��ȡһ�����������ʵ��װ��ͼ����ش��������⣺
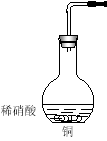

��1�������ҿ��л��������ռ�װ�õ�װ��ͼ��
��2���ٴ���ƿ��ȡ��������Ӧ�����Һ������������ˮ��д���÷�Ӧ�����ӷ���ʽ�� _______________
�ڷ�Ӧ�������ܷ��ȡ����ƿ���ټ���ϡ�����ķ�ʽ���ٻ��һ���������壿������ԣ���д����Ӧ�����ӷ���ʽ����������ԣ���˵�����ɣ�_________________________________
��3�������ͼװ�������ԵIJ����ǣ� ��
���𰸡�
I����1��C��
��1��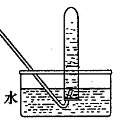 ��
��
��2����Cu2+ + 2NH3��H2O=Cu(OH)2��+ 2NH4+��2�֣���
�� 3Cu + 8H+ + 2NO3��=3Cu + 2NO��+ 4H2O��2������
��3����������ĩ������ˮ�У�����������ƿ��������ĩ�������ݷų�����ȴһ��ʱ���������һ��ˮ����֤��װ�����������á���2�֣�
��������
���������I��A��Ũ������ͭ��Ӧ������Ⱦ������NO2������B��ϡ������ͭ��Ӧ������Ⱦ������NO������C��ͭ��������Ӧ����CuO�������ᷴӦ�����������٣���û��������Ⱦ�����壬��ȷ��D��ͭ��Ũ���ᷴӦ������Ⱦ���������������������1��NO������ˮ��������ˮ���ռ���װ��Ϊ ����2������ƿ�з�Ӧ�����ҺΪ����ͭ������ͭ�백ˮ��Ӧ����������ͭ����������泥���Ӧ�����ӷ���ʽΪ��Cu2+ + 2NH3��H2O=Cu(OH)2��+ 2NH4+������Ӧ�����Һ�к�����������ӣ�����ϡ���ᣬ�ṩ�����ӣ������������£�H+��NO3-��Cu�ᷢ��������ԭ��Ӧ����NO����ͭ������Ӧ����NO�����ӷ���ʽΪ��3Cu + 8H+ + 2NO3��=3Cu + 2NO��+ 4H2O����3�����ڷ�Ӧ������μӣ���������Ҫ���װ�õ������ԣ����ķ�������������ĩ������ˮ�У�����������ƿ��������ĩ�������ݷų�����ȴһ��ʱ���������һ��ˮ����֤��װ��������������
����2������ƿ�з�Ӧ�����ҺΪ����ͭ������ͭ�백ˮ��Ӧ����������ͭ����������泥���Ӧ�����ӷ���ʽΪ��Cu2+ + 2NH3��H2O=Cu(OH)2��+ 2NH4+������Ӧ�����Һ�к�����������ӣ�����ϡ���ᣬ�ṩ�����ӣ������������£�H+��NO3-��Cu�ᷢ��������ԭ��Ӧ����NO����ͭ������Ӧ����NO�����ӷ���ʽΪ��3Cu + 8H+ + 2NO3��=3Cu + 2NO��+ 4H2O����3�����ڷ�Ӧ������μӣ���������Ҫ���װ�õ������ԣ����ķ�������������ĩ������ˮ�У�����������ƿ��������ĩ�������ݷų�����ȴһ��ʱ���������һ��ˮ����֤��װ��������������

 ��ҵ����ϵ�д�
��ҵ����ϵ�д� ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д�