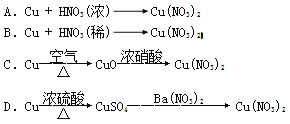
题目内容
【题目】已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子。请根据以上信息,回答下列问题(用所对应的元素符号表示):
(1)A、B、E的第一电离能由小到大的顺序为 。
(2)氢化物A2H4分子中A原子采取 杂化。
(3)按原子的外围电子排布分区,元素F在 区,基态F原子的电子排布式为 。
(4)元素A和C可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为 。
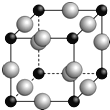
(5)A、F形成某种化合物的晶胞结构如下图所示(其中A显﹣3价,每个球均表示1个原子),则其化学式为 。设阿伏加德罗常数为NA,距离最近的两个F原子的核间距为a cm,则该晶胞的密度为(用含a和NA的代数式表示) g/cm3。
【答案】(1)Na<S<N
(2)sp3
(3)ds;1s22 s22p63s23p63d104s1或[Ar] 3d104s1
(4)共价键
(5)Cu3N;![]()
【解析】试题分析:A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中基态A原子价电子排布式为nsnnpn+1,而n=2,则A为N元素;E原子核外的M层中只有两对成对电子,外围电子排布为3s23p4,则E为S元素;化合物B2E为离子化合物,B表现+1价,原子序数大于碳、小于硫,则B为Na;C元素是地壳中含量最高的金属元素,则C为Al;D单质常用于制作太阳能电池和集成电路芯片,则D为Si;F原子最外层电子数与B的相同,其余各内层轨道均充满电子,原子序数大于硫,处于第四周期,核外电子数为2+8+18+1=19,则F为Cu。
(1)N元素2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,同周期随原子序数增大第一电离能呈增大趋势,同主族自上而下第一电离能减小,故第一电离能:Na<S<O<N。
故答案为:Na<S<N;
(2)(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物,氢化物N2H4分子中,每个N原子形成2个N-H键、1个N-N键,还含有1对孤对电子,故N原子采取sp3杂化。
故答案为:sp3;
(3)Cu属于ⅠB元素,核外电子排布式为1s22 s22p63s23p63d104s1或[Ar] 3d104s1,按原子的外围电子排布分区,元素Cu在ds区。
故答案为:ds;1s22 s22p63s23p63d104s1或[Ar] 3d104s1;
(4)元素N和Al可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,该化合物属于原子晶体,其化合物中所含的化学键类型为共价键。
故答案为:共价键;
(5)A、F形成某种化合物的晶胞结构如图所示的立方晶胞(其中A显-3价,每个球均表示1个原子),晶胞中小黑色球数目为8×![]() =1,大灰色球数目为12×
=1,大灰色球数目为12×![]() =3,其中N显-3价,则小黑色球为N原子、大灰色球为Cu,则其化学式为Cu3N;设阿伏伽德罗常数为NA,晶胞质量为
=3,其中N显-3价,则小黑色球为N原子、大灰色球为Cu,则其化学式为Cu3N;设阿伏伽德罗常数为NA,晶胞质量为![]() g,距离最近的两个Cu原子的核间距为a cm,则晶胞棱长为
g,距离最近的两个Cu原子的核间距为a cm,则晶胞棱长为![]() acm×2=
acm×2=![]() acm,则该化合物的晶胞密度为:
acm,则该化合物的晶胞密度为: =
=![]() g/cm3。
g/cm3。
故答案为:Cu3N;![]()

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案