题目内容
【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=___kJ·mol-1。
(2)常用脱硫剂的脱硫效果及反应条件如表,则最佳脱硫剂为___。
脱硫剂 | 出口硫/(mg·m-3) | 脱硫温度/℃ | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸汽再生 |
活性碳 | <1.33 | 常温 | 0~3.0 | 蒸汽再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锌锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生如下热分解反应:H2S(g)![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
控制不同的温度和压强进行实验,结果如图1所示。
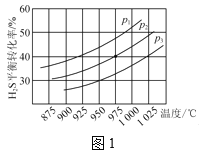
(1)p1、p2、p3由大到小的顺序为___。
()保持压强不变,能提高H2S的平衡转化率的措施有__(写一条)。
Ⅲ.间接电解法脱硫
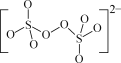
间接电解法脱硫原理如图2所示(吸收反应器中盛放FeCl3溶液,电解反应器的阴极、阳极均为惰性电极)。
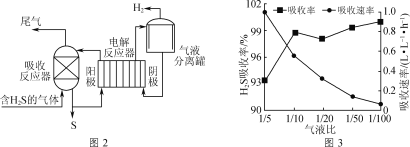
(1)吸收反应器中发生反应的离子方程式为___。
(2)反应器阴极生成H2的电极反应式为__。
(3)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图3所示。随着气液比减小,H2S的吸收率呈上升趋势的原因为___。
【答案】(a-2b) 活性炭 p3>p2>p1 适当升高温度、移出部分产物 2Fe3++H2S=2Fe2++S↓+2H+ 2H++2e-=H2↑ 气液比减小,通入H2S气体的流速减小,H2S与FeCl3溶液接触时间增加,H2S的吸收率增大
【解析】
Ⅰ. (1)①根据盖斯定律:2×①-2×②可得空气氧化脱除H2S反应的ΔH;
(2)结合表中信息,选出最佳脱硫剂;
Ⅱ.热分解法脱硫:H2S(g)![]() H2(g)+
H2(g)+![]() S2(g),结合该反应根据压强、温度对平衡移动的影响规律进行分析;
S2(g),结合该反应根据压强、温度对平衡移动的影响规律进行分析;
Ⅲ.间接电解法是通过FeCl3溶液吸收并氧化H2S气体,FeCl3溶液被还原为FeCl2,反应后溶液通过电解再生即将FeCl2氧化为FeCl3,据此书写离子方程式和电极方程;
分析电解法处理过程,区别吸收速率和吸收率的不同,间接电解法是通过FeCl3溶液吸收并氧化H2S气体,FeCl3溶液被还原为FeCl2,反应后溶液通过电解再生即将FeCl2氧化为FeCl3。
Ⅰ.干法脱硫
(1)①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1,②S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1,根据盖斯定律:方程式则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=2×①-2×②= (a-2b)kJ·mol-1。
故答案为: (a-2b);
(2)结合表中信息,活性炭的出口硫小,温度为常温,操作压力较小,且可再生,故最佳脱硫剂为活性炭,故答案为:活性炭;
Ⅱ.热分解法脱硫
(1)该反应的正反应方向为气体分子数增大,增大压强平衡逆向移动,H2S的平衡转化率减小,即压强越大,H2S的平衡转化率越小,则有p3>p2>p1;
(2)由图可知升高温度,H2S的平衡转化率增大,说明升高温度平衡正向移动,则正反应为吸热反应;若要进一步提高H2S的平衡转化率,除了改变温度和压强外,还可以通过减少生成物的浓度使平衡正向移动,即移出产物H2或S2;
故答案为: p3>p2>p1 ;适当升高温度、移出部分产物;
Ⅲ.间接电解法脱硫
间接电解法是通过FeCl3溶液吸收并氧化H2S气体,FeCl3溶液被还原为FeCl2,反应后溶液通过电解再生即将FeCl2氧化为FeCl3,所以电解反应器总反应的离子方程式为2Fe3++2H+![]() 2Fe2++H2↑。
2Fe2++H2↑。
(1)吸收反应器中发生铁离子氧化硫化氢,反应的离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+;
(2)反应器阴极氢离子得电子生成H2的电极反应式为2H++2e-=H2↑ ;
(3)结合反应原理和图象分析,气液比减小,通入H2S的总量减少,参加反应的H2S的量减少,吸收速率减小;吸收液的量增大,气液接触更充分,使硫化氢的吸收率增大,
故答案为:气液比减小,通入H2S的总量减少,参加反应的H2S的量减少,吸收速率减小;吸收液的量增大,气液接触更充分,使硫化氢的吸收率增大。

【题目】为了探究铁及其化合物的氧化性和还原性,某同学设计了如下实验方案,其中符合实验要求且完全正确的是( )
选项 | 实验操作 | 实验现象 | 离子反应 | 实验结论 |
A | 向氯化亚铁溶液中通入氯气 | 浅绿色溶液变成棕黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
B | 在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成无色溶液 | Fe2++Zn=Fe+Zn2+ | Fe2+具有还原性 |
C | 在氯化铁溶液中加入铁粉 | 棕黄色溶液变成浅绿色溶液 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
D | 在氯化铁溶液中加入铜粉 | 蓝色溶液变成棕黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe2+具有氧化性 |
A.AB.BC.CD.D
【答案】A
【解析】
A.向氯化亚铁溶液中通入氯气,浅绿色溶液变成棕黄色溶液,说明Fe2+具有还原性,发生的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故A正确;
B.在氯化亚铁溶液中加入锌片,浅绿色溶液变成无色溶液,说明Fe2+具有氧化性,发生的离子反应为Fe2++Zn=Fe+Zn2+,故B错误;
C.离子方程式电荷不守恒,正确的离子方程式为2Fe3++Fe=3Fe2+,故C错误;
D.在氯化铁溶液中加入铜粉,溶液颜色应由棕黄色变成蓝色,故D错误;
故答案为A。
【题型】单选题
【结束】
18
【题目】某无色的混合气体甲中可能含有NO2、NO、CO2、O2、NH3、N2中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为(不考虑Na2O2与NO2、NO的反应)( )
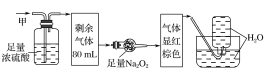
A.NO2、CO2、N2B.NH3、NO、CO2
C.NH3、N2、CO2D.NO、O2、NH3
【题目】氢能是一种公认的高热值清洁能源,目前世界各国正致力于将高污染高排放的碳能源过渡成清洁高效低排放的氢能源。氢能开发包括以下三个环节:
一、氢燃料的制备
(1)我国氢气的主要来源是焦炉气制氢,所制得的氢气含有较多的CO和H2S,中温干法脱硫是用氧化铁将硫元素转化为硫化铁。干法脱硫的反应方程式为________。
(2)我国科研人员用木屑水蒸汽气化制取氢燃料,在一定条件下,反应器中存在如下反应:
i.CO2 (g) +C(s)=2CO (g) △H1
ii.C(s) + H2O(g)=CO ( g) + H2 (g) △H2
iii.C(s) + 2H2 (g)=CH4( g) △H3
iv.CO(g) + H2O(g)=CO2 ( g) + H2 (g) △H4
v. CH4(g)+ 2 H2O(g)= CO2 ( g) + 4H2 (g) △H5
①△H5=_________________ 。
②研究中 CaO 的添加量按照CaO 中所含的Ca 和松木屑所含碳的物质的量比确定,在750℃,控制水蒸气流量为 0.lg/(ming)下,探究催化剂加入量对产气组分和气化性能的影响,结果如表所示:
n(Ca)/n(C) | 气体体积分数 | 碳转化率/% | |||
H2 | CO | CO2 | CH4 | ||
0 | 45.58 | 22.70 | 22.37 | 7.54 | 61.22 |
0.5 | 52.95 | 21.74 | 19.11 | 5.14 | 56.59 |
1.0 | 58.62 | 22.37 | 12.60 | 5.31 | 61.42 |
由表中数据,n(Ca) / n(C) =___时最为合理。 n(Ca) / n(C) 由0到0.5时,H2的体积分数显著增加的原因_____。体系的气化温度不仅对木屑的热解气化反应有影响 ,而且对 CaO 吸收 CO2 的能力以及 CaCO3的分解反应也有很大影响。实验过程中,控制 n(Ca) / n(C) 为 1.0,水蒸气流量为0.1 g/(min g), 将气化反应温度从700℃升到850℃,气化温度对产氢率、产气率的影响如表:
温度/℃ | 气体体积分数 | 碳转化率/% | ||
H2 | CO | CO2 | ||
700 | 51.78 | 20.75 | 19.89 | 54.37 |
750 | 58.62 | 22.37 | 12.60 | 61.42 |
800 | 55.63 | 26.05 | 12.71 | 73.43 |
850 | 54.16 | 26.94 | 13.82 | 83.34 |
③从产氢率的角度考虑,最佳操作温度是________________。
④随着反应的进行,发现 CaO 的吸收能力逐渐降低,原因是___________。
二、氢燃料的存储
(3)将氢气储存于液体燃料中,可以解决氢气的安全高效存储和运输问题。由于甲醇具有单位体积储氢量高、活化温度低等优点,是理想的液体储氢平台分子。我国学者构建一种双功能结构的催化剂,反应过程中,在催化剂的表面同时活化水和甲醇。如图是甲醇脱氢转化的反应历程( TS 表示过渡态)。
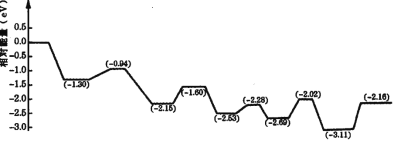
根据图像判断甲醇脱氢反应中断裂的化学键是______,该反应的△H___0( 填“大于”、“等于”或“小于”)
三、氢燃料的应用。一种氢能电池的原理如图:
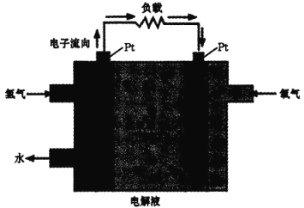
(4)正极的电极反应式为________。在 Pt 电极表面镜一层细小的铅粉,原因是______。