题目内容
【题目】计算填空:
(1)3.1 g Na2X含有Na+ 0.1 mol,则Na2X的摩尔质量为________
(2)当SO2、SO3的质量比为1∶1时,氧原子数之比为________
(3)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为________g。
【答案】62g/mol 5:6 8.0
【解析】
(1)3.1g的Na2X中含有Na+的物质的量为0.1mol,则Na2X的物质的量= ![]() =0.05mol,Na2X的摩尔质量=
=0.05mol,Na2X的摩尔质量= ![]() =62g/mol,故答案为:62g/mol;
=62g/mol,故答案为:62g/mol;
(2)1个SO2分子中含有2个氧原子,1个SO3分子中含有3个氧原子,当SO2、SO3的质量比为1∶1时,物质的量之比等于相对分子质量的反比= ![]() =5:4,氧原子数之比为
=5:4,氧原子数之比为![]() =5:6,正确答案是:5:6;
=5:6,正确答案是:5:6;
(3)由反应H++OH-=H2O可知,n(NaOH)=n(HCl)=0.2mol,n(NaOH)=n(HCl)=0.2mol,m(NaOH)=0.2mol×40g/mol=8.0g,故答案为: 8.0g。

【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=___kJ·mol-1。
(2)常用脱硫剂的脱硫效果及反应条件如表,则最佳脱硫剂为___。
脱硫剂 | 出口硫/(mg·m-3) | 脱硫温度/℃ | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸汽再生 |
活性碳 | <1.33 | 常温 | 0~3.0 | 蒸汽再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锌锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生如下热分解反应:H2S(g)![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
控制不同的温度和压强进行实验,结果如图1所示。
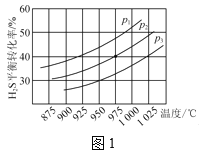
(1)p1、p2、p3由大到小的顺序为___。
()保持压强不变,能提高H2S的平衡转化率的措施有__(写一条)。
Ⅲ.间接电解法脱硫
间接电解法脱硫原理如图2所示(吸收反应器中盛放FeCl3溶液,电解反应器的阴极、阳极均为惰性电极)。
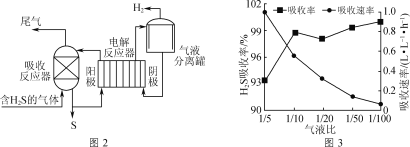
(1)吸收反应器中发生反应的离子方程式为___。
(2)反应器阴极生成H2的电极反应式为__。
(3)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图3所示。随着气液比减小,H2S的吸收率呈上升趋势的原因为___。