题目内容
【题目】氢能是一种公认的高热值清洁能源,目前世界各国正致力于将高污染高排放的碳能源过渡成清洁高效低排放的氢能源。氢能开发包括以下三个环节:
一、氢燃料的制备
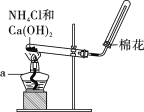
(1)我国氢气的主要来源是焦炉气制氢,所制得的氢气含有较多的CO和H2S,中温干法脱硫是用氧化铁将硫元素转化为硫化铁。干法脱硫的反应方程式为________。
(2)我国科研人员用木屑水蒸汽气化制取氢燃料,在一定条件下,反应器中存在如下反应:
i.CO2 (g) +C(s)=2CO (g) △H1
ii.C(s) + H2O(g)=CO ( g) + H2 (g) △H2
iii.C(s) + 2H2 (g)=CH4( g) △H3
iv.CO(g) + H2O(g)=CO2 ( g) + H2 (g) △H4
v. CH4(g)+ 2 H2O(g)= CO2 ( g) + 4H2 (g) △H5
①△H5=_________________ 。
②研究中 CaO 的添加量按照CaO 中所含的Ca 和松木屑所含碳的物质的量比确定,在750℃,控制水蒸气流量为 0.lg/(ming)下,探究催化剂加入量对产气组分和气化性能的影响,结果如表所示:
n(Ca)/n(C) | 气体体积分数 | 碳转化率/% | |||
H2 | CO | CO2 | CH4 | ||
0 | 45.58 | 22.70 | 22.37 | 7.54 | 61.22 |
0.5 | 52.95 | 21.74 | 19.11 | 5.14 | 56.59 |
1.0 | 58.62 | 22.37 | 12.60 | 5.31 | 61.42 |
由表中数据,n(Ca) / n(C) =___时最为合理。 n(Ca) / n(C) 由0到0.5时,H2的体积分数显著增加的原因_____。体系的气化温度不仅对木屑的热解气化反应有影响 ,而且对 CaO 吸收 CO2 的能力以及 CaCO3的分解反应也有很大影响。实验过程中,控制 n(Ca) / n(C) 为 1.0,水蒸气流量为0.1 g/(min g), 将气化反应温度从700℃升到850℃,气化温度对产氢率、产气率的影响如表:
温度/℃ | 气体体积分数 | 碳转化率/% | ||
H2 | CO | CO2 | ||
700 | 51.78 | 20.75 | 19.89 | 54.37 |
750 | 58.62 | 22.37 | 12.60 | 61.42 |
800 | 55.63 | 26.05 | 12.71 | 73.43 |
850 | 54.16 | 26.94 | 13.82 | 83.34 |
③从产氢率的角度考虑,最佳操作温度是________________。
④随着反应的进行,发现 CaO 的吸收能力逐渐降低,原因是___________。
二、氢燃料的存储
(3)将氢气储存于液体燃料中,可以解决氢气的安全高效存储和运输问题。由于甲醇具有单位体积储氢量高、活化温度低等优点,是理想的液体储氢平台分子。我国学者构建一种双功能结构的催化剂,反应过程中,在催化剂的表面同时活化水和甲醇。如图是甲醇脱氢转化的反应历程( TS 表示过渡态)。
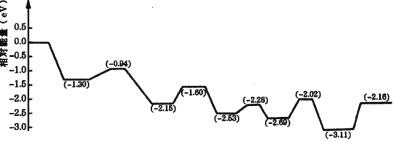
根据图像判断甲醇脱氢反应中断裂的化学键是______,该反应的△H___0( 填“大于”、“等于”或“小于”)
三、氢燃料的应用。一种氢能电池的原理如图:
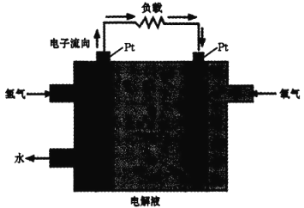
(4)正极的电极反应式为________。在 Pt 电极表面镜一层细小的铅粉,原因是______。
【答案】Fe2O3+3H2S =Fe2S3+3H2O ΔH5=2ΔH2-ΔH1-ΔH3 或 ΔH5=2ΔH4-ΔH3+ΔH1或ΔH5=ΔH2+ΔH4-ΔH3 1 CaO作为CO2 的吸收剂,使产气中CO2 分压降低,从而使水煤气变换反应平衡向生成H2 的方向移动 750℃ CaO吸收CO2产生的CaCO3附着在CaO的表面,阻止了CaO对CO2的进一步吸收 O-H键和C-H键 小于 O2+2H2O+4e-=4OH- 铂粉吸附气体的能力强
【解析】
(1)根据题干可知,该反应为氧化铁与硫反应,生成硫化铁和水,据此作答;
(2)①根据盖斯定律v=2×ii- i- iii=2×iv-iii+i= ii+ iv- iii,作答;
②根据表格中产氢率,分析n(Ca) / n(C)时最为合理;n(Ca) / n(C)由0到0.5时,H2的体积分数显著增加的原因是CaO作为CO2 的吸收剂,使产气中CO2 分压降低,从而使水煤气变换反应平衡向生成H2 的方向移动;
③根据表格分析;
④CaO与二氧化碳反应生成碳酸钙;
(3)甲醇的分子式为CH3OH,脱氢反应中断裂的化学键是O-H键和C-H键;该反应的相对能量降低,反应放热;
(4)正极得电子,发生还原反应;粉末吸附气体的能力强,增加反应速率。
(1)根据题干可知,该反应为氧化铁与硫反应,生成硫化铁和水,反应方程式为:Fe2O3+3H2S =Fe2S3+3H2O,故答案为:Fe2O3+3H2S =Fe2S3+3H2O;
(2)①根据盖斯定律v=2×ii- i- iii=2×iv-iii+i= ii+ iv- iii,则ΔH5=2ΔH2-ΔH1-ΔH3=ΔH5=2ΔH4-ΔH3+ΔH1=ΔH5=ΔH2+ΔH4-ΔH3,故答案为:ΔH5=2ΔH2-ΔH1-ΔH3 或 ΔH5=2ΔH4-ΔH3+ΔH1或ΔH5=ΔH2+ΔH4-ΔH3;
②根据表格中产氢率,n(Ca) / n(C)=1时最高;n(Ca) / n(C)由0到0.5时,H2的体积分数显著增加的原因是CaO作为CO2 的吸收剂,使产气中CO2 分压降低,从而使水煤气变换反应平衡向生成H2 的方向移动,故答案为:1;CaO作为CO2 的吸收剂,使产气中CO2 分压降低,从而使水煤气变换反应平衡向生成H2 的方向移动;
③根据表格可知750℃时,产氢率最高,故答案为:750℃;
④CaO与二氧化碳反应生成碳酸钙,附着在CaO的表面,阻止了CaO对CO2的进一步吸收,故答案为:CaO吸收CO2产生的CaCO3附着在CaO的表面,阻止了CaO对CO2的进一步吸收;
(3)甲醇的分子式为CH3OH,脱氢反应中断裂的化学键是O-H键和C-H键;该反应的相对能量降低,反应放热,故答案为:O-H键和C-H键;小于;
(4)正极得电子,发生还原反应,电极方程式为:O2+2H2O+4e-=4OH-;粉末吸附气体的能力强,增加反应速率,故答案为:O2+2H2O+4e-=4OH-;铂粉吸附气体的能力强。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】H2S是石油化工行业广泛存在的污染性气体,但同时也是重要的氢源和硫源,工业上可以采取多种方式处理。
Ⅰ.干法脱硫
(1)已知:2H2S(g)+3O2(g)=2SO2(g)+2H2O(l);ΔH1=akJ·mol-1
S(s)+O2(g)=SO2(g);ΔH2=bkJ·mol-1
则空气氧化脱除H2S反应2H2S(g)+O2(g)=2S(s)+2H2O(l)的ΔH=___kJ·mol-1。
(2)常用脱硫剂的脱硫效果及反应条件如表,则最佳脱硫剂为___。
脱硫剂 | 出口硫/(mg·m-3) | 脱硫温度/℃ | 操作压力(MPa) | 再生条件 |
一氧化碳 | <1.33 | 300~400 | 0~3.0 | 蒸汽再生 |
活性碳 | <1.33 | 常温 | 0~3.0 | 蒸汽再生 |
氧化锌 | <1.33 | 350~400 | 0~5.0 | 不再生 |
锌锰矿 | <3.99 | 400 | 0~2.0 | 不再生 |
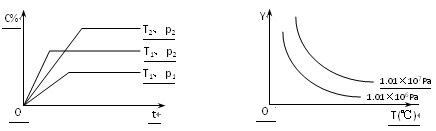
Ⅱ.热分解法脱硫
在密闭容器中,充入一定量的H2S气体,发生如下热分解反应:H2S(g)![]() H2(g)+
H2(g)+![]() S2(g)
S2(g)
控制不同的温度和压强进行实验,结果如图1所示。
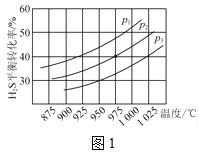
(1)p1、p2、p3由大到小的顺序为___。
()保持压强不变,能提高H2S的平衡转化率的措施有__(写一条)。
Ⅲ.间接电解法脱硫
间接电解法脱硫原理如图2所示(吸收反应器中盛放FeCl3溶液,电解反应器的阴极、阳极均为惰性电极)。
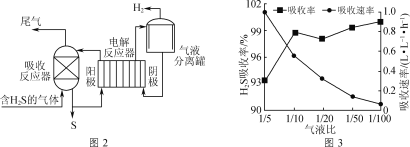
(1)吸收反应器中发生反应的离子方程式为___。
(2)反应器阴极生成H2的电极反应式为__。
(3)气液比为气体与液体的流速比,吸收反应器内液体流速固定。测定吸收器中相同时间内不同气液比下H2S的吸收率和吸收速率,结果如图3所示。随着气液比减小,H2S的吸收率呈上升趋势的原因为___。
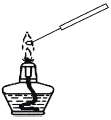
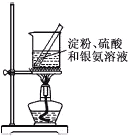
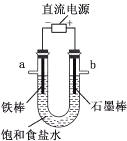
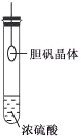
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.用铂丝蘸取NaCl溶液置于酒精灯火焰上灼烧,火焰呈黄色 | B.将少量银氨溶液加入盛有淀粉和硫酸的试管中,加热,产生光亮的银镜 | C.饱和食盐水通电一段时间后,湿润的KI-淀粉试纸遇b处气体变蓝色 | D.将胆矾晶体悬挂于盛有浓H2SO4的密闭试管中,蓝色晶体逐渐变为白色 |
A. A B. B C. C D. D