题目内容
【题目】(1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下:
____ FeS2+ ____ H++ ____ NO3-= ____ Fe2++ ____ S↓+ ____ NO↑+ ____H2O
回答下列问题:配平此氧化还原反应方程式_____________________________________,还原剂为______________。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是_____(填字母)
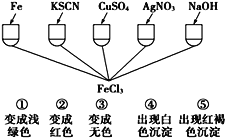
A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是________,此反应的离子方程式:________。
【答案】3、8、2、3、6、2、4 还原剂为FeS2 C Fe2+ 2Fe2++Cl2=2Fe3++2Cl-
【解析】
(1)FeS2中铁元素化合价+2价,硫元素化合价-1价,反应后硫元素化合价为0价,氮元素化合价+5价变化为+2价,结合原子守恒和电子守恒配平化学方程式,还原剂为元素化合价升高的物质;(2)①Fe与FeCl3溶液反应的离子方程式为:Fe + 2Fe3+= 3Fe2+;②KSCN与FeCl3溶液反应的离子方程式为:Fe3+ + 3SCN- = Fe(SCN)3;③硫酸铜与与FeCl3溶液不反应;④硝酸银与FeCl3溶液反应的离子方程式为:Cl-+ Ag+ =AgCl↓,产生白色沉淀,但不是Fe3+的性质;⑤氢氧化钠与FeCl3溶液反应的离子方程式为:Fe3+ + 3OH- = Fe(OH)3↓。
(3)还原性Fe2+>Br-,向FeBr2溶液中通入Cl2时,反应顺序为2Fe2++Cl2===2Fe3++2Cl-、2Br-+Cl2===Br2+2Cl-。
(1)FeS2中铁元素化合价+2价,硫元素化合价-1价,反应后硫元素化合价0价,氮元素化合价+5价变化为+2价,根据原子守恒和电子守恒配平离子方程式为:3FeS2+8H++2NO3-=3Fe2++6S↓+2NO↑+4H2O,还原剂为元素化合价升高的反应物,FeS2中硫元素化合价升高,所以FeS2是还原剂。
(2)①Fe与含Fe3+反应的离子方程式为:Fe + 2Fe3+= 3Fe2+,溶液由棕黄色变为浅绿色,正确;②KSCN与Fe3+反应的离子方程式为:Fe3+ + 3SCN- = Fe(SCN)3,溶液由棕黄色变为红色,正确;③硫酸铜与与FeCl3溶液不反应,溶液不会变为无色,错误;④硝酸银与Fe3+不能发生离子反应 ;⑤氢氧化钠与Fe3+反应的离子方程式为:Fe3+ + 3OH- = Fe(OH)3↓,出现红褐色沉淀,正确;故选C。
(3)还原性Fe2+>Br-,Fe2+先与Cl2反应,1L 0.2mol·L-1的FeBr2溶液中Fe2+的物质的量是0.2mol,根据2Fe2++Cl2===2Fe3++2Cl-,0.2mol Fe2+消耗氯气0.1mol,所以向1L 0.2mol·L-1的FeBr2溶液中通入标准状况下氯气2.24L,被氧化的粒子是Fe2+,反应离子方程式是2Fe2++Cl2=2Fe3++2Cl-。