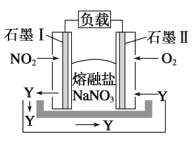
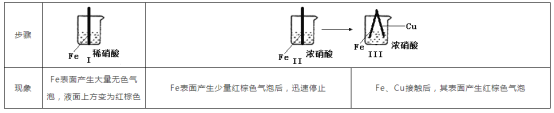
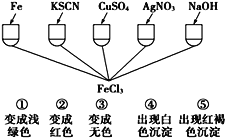
题目内容
【题目】下列计算结果正确是
A. 0.5L、8mol/L 浓盐酸与足量MnO2完全反应产生22.4L(标准状况下)Cl2
B. 2H2S+SO2=3S↓+2H2O反应中氧化产物与还原产物的物质的量之比为1:2
C. 将NO2和O2等体积混合充满一试管,倒置于水槽中,充分反应后,试管中剩余气体占试管容积的1/8
D. 标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为(1/22.4)mol/L
【答案】D
【解析】
A、浓盐酸与二氧化锰反应生成氯气,稀盐酸与二氧化锰不反应;
B、依据还原剂发生氧化反应得到氧化产物,氧化剂发生还原反应得到还原产物计算即可;
C、将NO2和O2等体积混合充满一试管,倒置于水槽中,发生![]() ,根据反应方程式计算剩余气体的体积;
,根据反应方程式计算剩余气体的体积;
D、设原氨气体积为VL,根据![]() 计算;
计算;
A、只有浓盐酸才能与二氧化锰发生反应生成氯气,随着反应的进行,盐酸的浓度变稀将不再反应,所以0.5L、8mol/L浓盐酸与足量MnO2完全反应产生Cl2的体积小于22.4L(标准状况下),故A错误;
B、该反应中,硫化氢作还原剂,氧化产物为S,二氧化硫作氧化剂,还原产物为S,由于硫化氢与二氧化硫的物质的量之比为2:1,所以氧化产物与还原产物的物质的量之比也为2:1,故B错误;
C、将NO2和O2等体积混合充满一试管,倒置于水槽中,发生![]() ,设试管的体积为8,则NO2和O2体积都是4,根据方程式,4体积的NO2消耗1体积的氧气,剩余氧气的体积为3,所以试管中剩余气体占试管容积的3/8,故C错误;
,设试管的体积为8,则NO2和O2体积都是4,根据方程式,4体积的NO2消耗1体积的氧气,剩余氧气的体积为3,所以试管中剩余气体占试管容积的3/8,故C错误;
D、设原氯化氢气体体积为VL,则标准状况下![]() ,当水充满整个烧瓶后,溶液体积为为VL,
,当水充满整个烧瓶后,溶液体积为为VL,![]()
![]() mol/L,故D正确。
mol/L,故D正确。

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案【题目】某化学小组采用如下装置用环己醇制备环己烯。
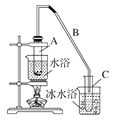
已知:环己醇和浓硫酸混合在85 ℃下制取环己烯。
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是________,导管B除了导气外还具有的作用是____________。
②试管C置于冰水浴中的目的是____________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在________层(填“上”或“下”),分液后用________(填入编号)洗涤。
A. KMnO4溶液 B. 稀硫酸 C. Na2CO3溶液
②再将环己烯按如图装置蒸馏,冷却水从________口进入。蒸馏时要加入生石灰,目的是__________________________________________。
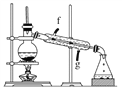
③收集产品时,控制的温度应在________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________。
a. 蒸馏时从70℃开始收集产品
b. 环己醇实际用量多了
c. 制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是___________;如果得实际得到产品质量为8.2 g, 则该实验的产率是_________________(保留3位有效数字)。
a. 用酸性高锰酸钾溶液 b. 用金属钠 c. 测定沸点